雄犬繁殖的检查和诊断方法
病史 很多生殖系统疾病继发或并发于其他器官系统疾病,特异性病史除外,与所有器官都有关联。应记录 以下几个方面:
特征描述:犬或者猫的品种、年龄等。
特征描述:犬或者猫的品种、年龄等。 一般病史:饮食、药物治疗、发病前状态、内分泌功能不良的表现,如呕吐、多尿、多饮、运动忍耐力差、 皮肤被毛异常和同窝动物的调查,包括流行性疾病。
繁殖史:以前的包皮分泌物,包皮团块,阴囊红肿、疼痛或者肿胀,雌性化倾向,排尿或者排粪时表现疼 痛。
饲养史:雄犬/雄猫发情时对雌犬/雌猫的兴趣、性欲、最后交配的细节,配种数量、自然还是人工授精、管 理配种时的设备,如阴道细胞学或者黄体酮的评价。雄性动物和雌性动物的关系,注意雄犬/雄猫是否实际上进 行了交配和交配的次数。
怀孕史:最后一次产仔的日期、怀孕率(怀孕数/哺乳数)、该雄性动物交配的雌性动物发生流产、平均产 仔数量和后代出现的遗传性疾病。
临床病理学:以前甲状腺和肾上腺功能的检查结果和时间,犬布鲁氏菌的检测和精子的评价。
犬舍和猫舍的管理:制订营养、房舍和饲养的计划,控制雄性犬、猫的旅行和展示总的时间。
[身体检查]
一般检查 彻底的检查身体所有系统,尤其是雄性犬和猫的骨骼肌肉系统,然后再按照解剖学结构进行特异 性生殖道检查。
阴囊、睾丸和生殖道检查 犬和猫的睾丸为卵圆形,在阴囊内背对排列。阴囊皮肤很薄,有色素沉着,被有 被毛,皮肤上有许多汗腺和微小的皮下脂肪(图5.143)。正常的雄性犬和猫有两个阴囊睾丸,它们两侧对称, 光滑、质地均匀、富有弹性。睾丸的大小可以使用测径器测量阴囊宽度,也可以直接在超声检查的影像下进行 测量。睾丸的重量也与体重、睾丸大小和阴囊宽度有关(表5.50)。附睾、输精管、精索可以通过触诊观察有无 异常。附睾头位于背前方,身体在奔跑时附睾尾在后部(图5.144)。对于雄性猫,FIP感染会导致阴囊内的液体 聚集。
表5.50 犬阴囊宽度和总的精子产生的关系(也由犬的体重来决定)

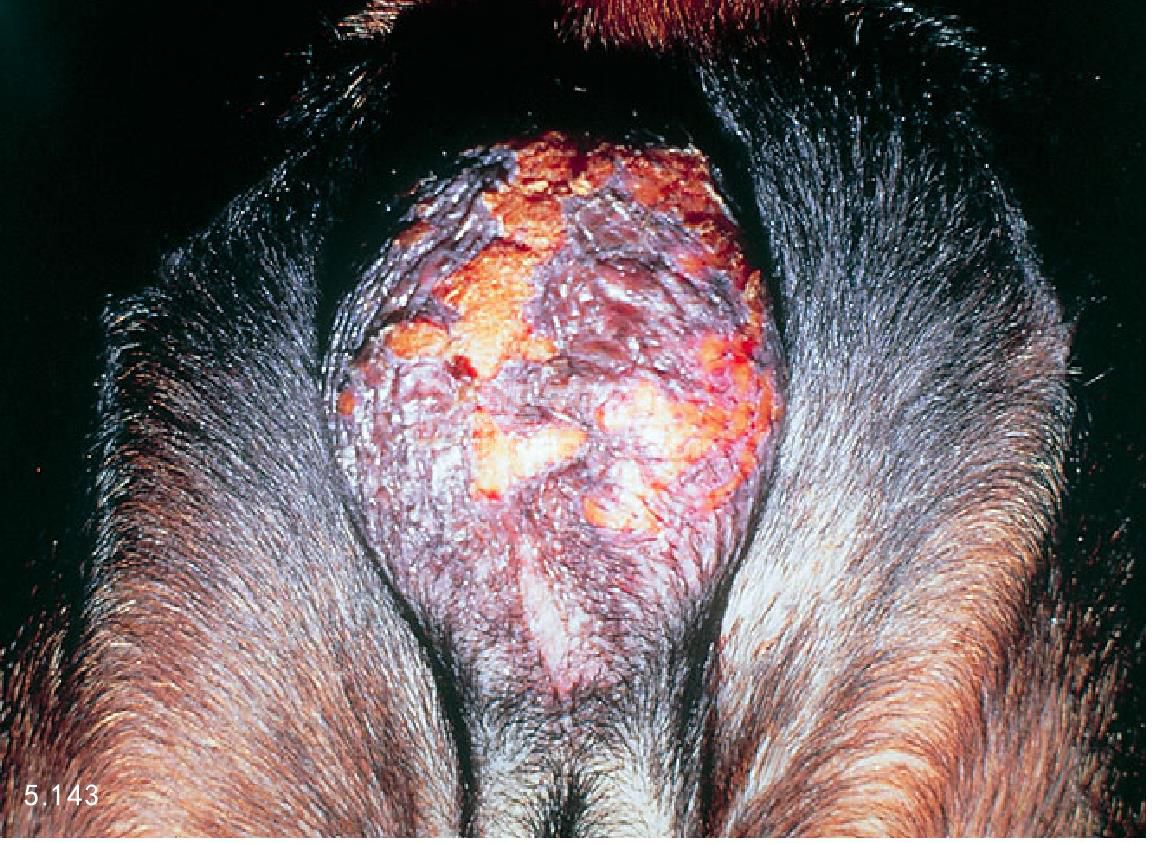
图5.143 犬冻伤而发生阴囊皮炎,严重的皮炎会暂时性或者永久抑制精子的产生。
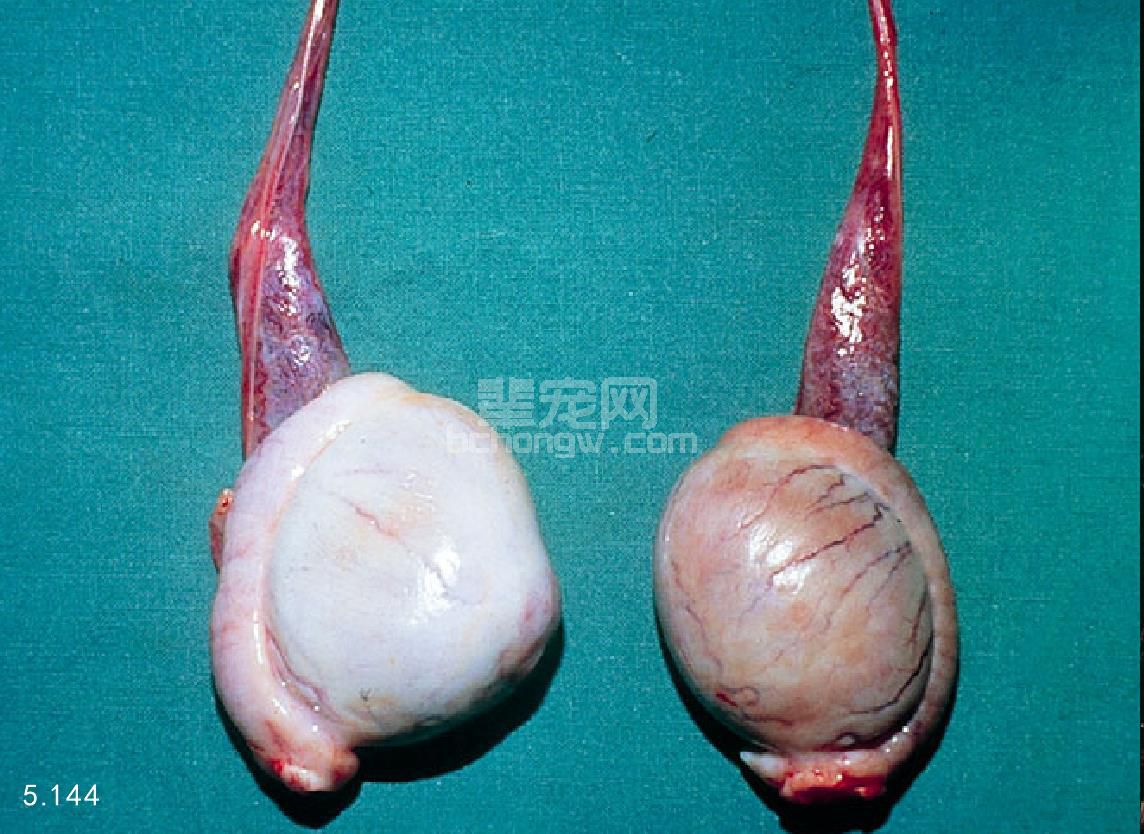
图5.144 犬的双侧睾丸。附睾沿着睾丸的中间出现嵴。
阴茎和包皮 犬的阴茎由肌肉、海绵体和骨骼组成,阴茎头由两部分组成:阴茎头球包含有勃起组织,正 中间包裹着尿道和阴茎骨;龟头延长部的背部和侧面 为勃起组织。阴茎骨一直延伸到阴茎头球几乎到达了 龟头的顶端,在原处对阴茎和包皮触诊,使阴茎伸 出,检查包皮内膜,是否出现炎症、分泌物、创伤、 异物或者团块的情况。在阴茎勃起收集精液时还要做 一次检查(图5.145)。在非勃起状态下触诊阴茎骨以便检查骨折和先天性异常。雄猫的阴茎有大量血管,倒 钩隐藏(图5.146)。倒钩的生长受到睾丸激素的影响,而阉割猫没有倒钩。要注意现在的和以前存在的尿路 疾病的迹象。
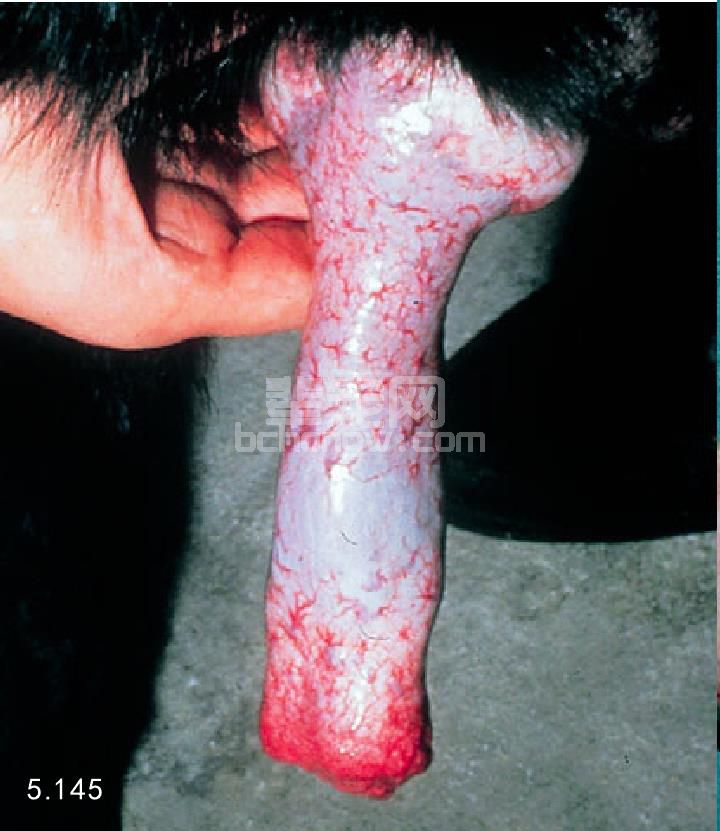
图5.145 精液采集后检查勃起阴茎的异常。
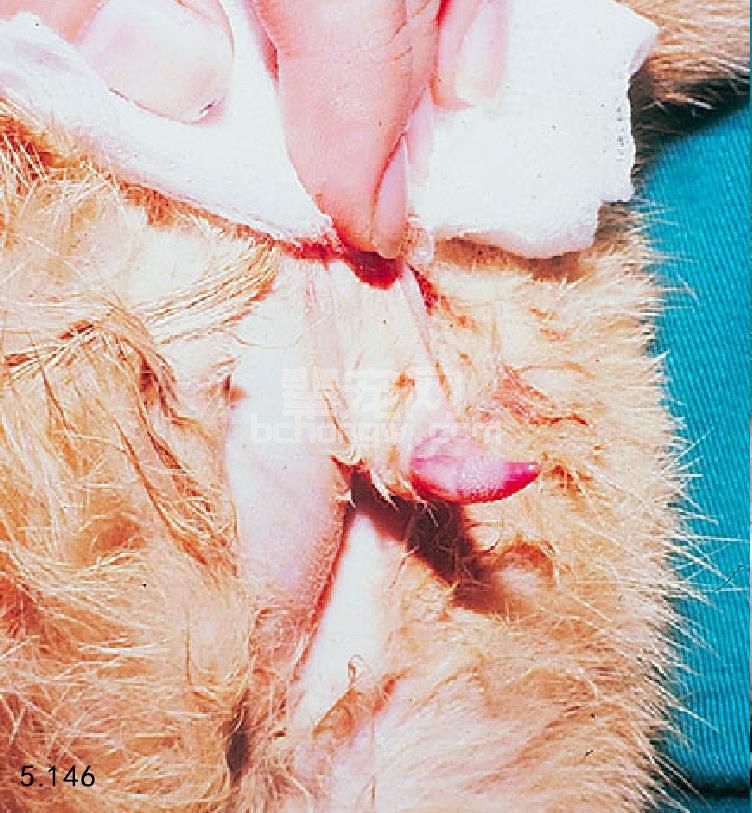
图5.146 接近雄猫检查阴茎时需要镇静。
前列腺 前列腺是犬唯一的附属性腺,位于骨盆底前端,包裹着尿道,前面与膀胱颈相邻。对称的球形,由 中嵴分为两叶,大小、密度和对称性变化可通过直肠触诊检查到。提起犬的前半侧身体便于触诊,另一只手隔 离腹部内的前列腺使其向直肠处移动。猫的前列腺和尿道球腺不容易触诊到。
[临床病理]
血液学 CBC、生化检查和尿液分析有助于检测原发性的生殖道疾病和潜在的全身性疾病,并且对于预后也 有判断价值。
血清学 对于繁殖用犬每隔6个月做一次犬布鲁氏菌效价的测定。
内分泌学 肾上腺和甲状腺的疾病在其他动物中与不育有关,但是对于犬,甲状腺功能减退和低生育力的关 系还不是很清楚。根据刺激试验结果可诊断肾上腺和甲状腺功能的异常,要确诊本病可进行激素水平检查。
[犬的精液采集和评价]
方法 犬精液的采集,在进行操作时,最好有发情雌犬的存在,用手刺激射精,有些犬在没有发情的雌犬 存在或者没有雌犬存在的情况下也可以射精,在没有雌犬的时候,使用信息素,甲基-p-羟基-苯甲酸盐或者 擦洗发情雌犬的阴道液体作为催情物。正确的采集者要位于犬的右侧,用阴茎包皮轻轻摩擦阴茎直到阴茎勃起 为之,犬的阴茎于是从阴囊中伸出用食指和拇指给予龟头近端轻微的压力。通过这种手淫可以引发射精,注意 不要粗暴地操作,防止表面血管的出血。开始射出的部分缺少精子、透明,紧跟着是浑浊的富含精子的部分, 骨盆的挤压会伴有第一次和第二次的射精,第三次射精的精液包含有前列腺液,澄清而量大。在第三部分的射 精期间,犬可能会跨过操笔者的前臂。在第二部分和第三部分的射精可以更换精液收集器具,分开收集前列腺 液。没有必要收集所有的前列腺液。注意观察10~20分钟,确保勃起消失,阴茎回缩到阴囊内。
雄猫精液的收集可以利用人工阴道来进行,但操作比较困难,费时,获得的样本没有典型性。交配后的阴道 有助于确定是否受孕但不能出现典型样本。精液样本可以通过麻醉后的电刺激射精来获取,倒退性射精经常发 生,对于正常的雄性猫其精液的特点,尤其是量和浓度的变化范围很大。
精子的处理 精子收集器具和收集到的精子样本应放置于37℃直到完全液化。避免存在一些潜在的杀精子的 物质,如清洁剂、某些凝胶体、污垢和细菌。尽可能少的使精液暴露于润滑剂和乳胶中。低劣的技术、经验少 的犬、对周边环境不熟悉、过度刺激精液收集区域、没有发情期的雌犬,或者与生殖骨骼肌肉系统损伤有关的 疼痛,都会导致精液采集的失败。
精子评价 精子在采集完后应该立即进行评价(表5.51和表5.52)。评估的精子通常只包括初次和第二次射 出的精液,而不包括第三次射出的精液。记录精子的总数,颜色应该为云雾状或者乳白色。在有尿液污染或者 存在红细胞以及白细胞时会发生颜色异常。精液的pH一般在6.1~7.0之间,这有助于选择合适的抗生素治疗前列 腺炎,因为对于酸性前列腺液的犬使用碱性的抗生素在前列腺中的抗生素浓度会蓄积很高,反之亦然。
表5.51 犬精液的正常值
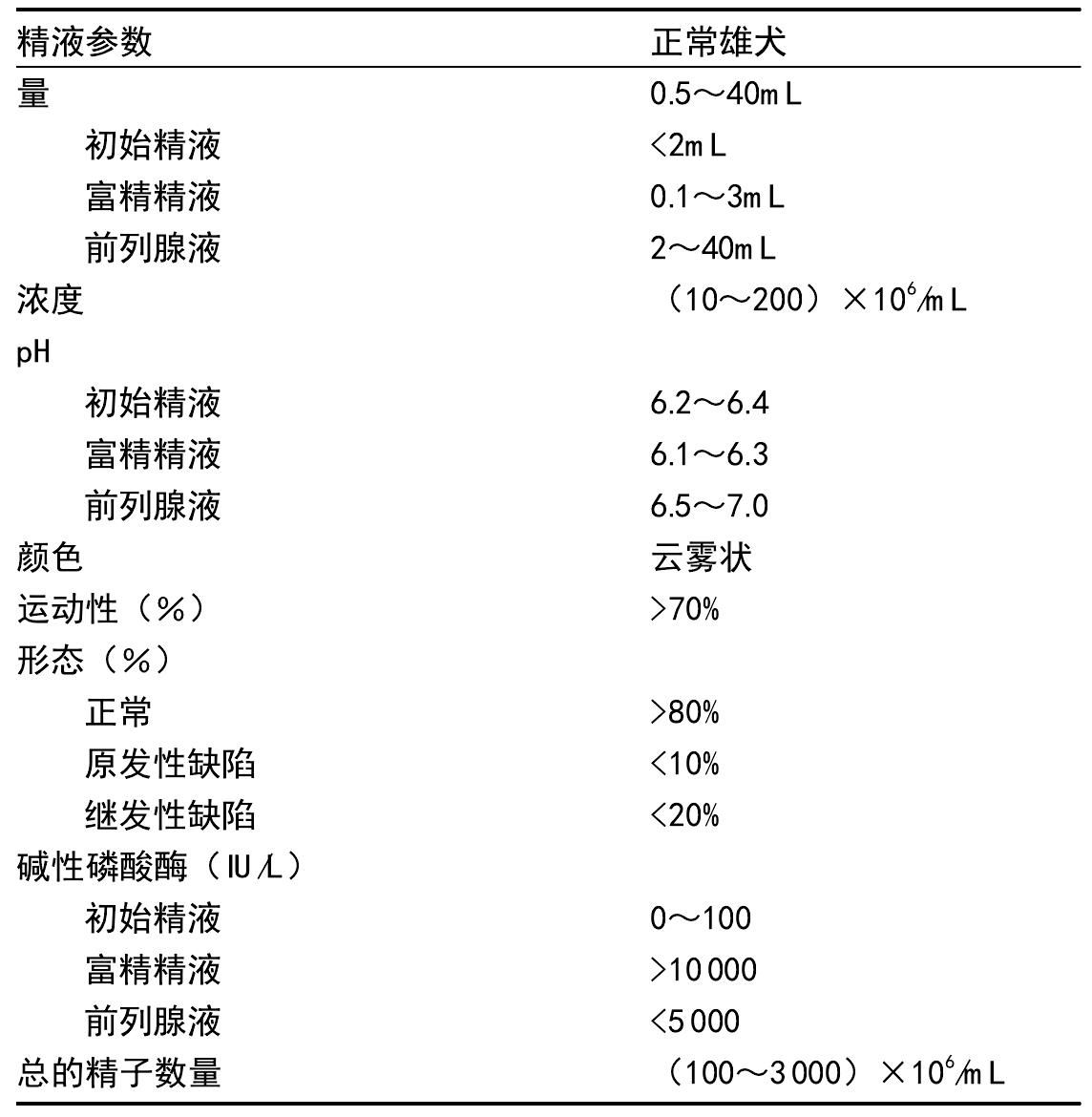
表5.52 猫精液的正常值

滴一滴精液到预热的载玻片上(图5.147),盖上 盖玻片,利用相差显微镜对向前运动性、精子的凝集性 和存在的碎片进行评价。前进的运动性是指向前呈直线 快速运动的精子数占总精子数的百分比(图5.148)。 浓稠的精液应使用等渗盐水、柠檬酸钠或者精液添加剂 稀释后再做向前运动性评价。正常精液有大于70%的精 子具有前进运动性。
一次射出的精液中精子的总数量可以通过精子浓 度(在血球计数器上计数已知稀释倍数的精液)和精 液体积的乘积来计算。浓度范围通常在(100~3 000)× 10 6 /mL。总的精子数量依赖于睾丸的重量,因此受到体 重的影响。如果犬的体重是20~50kg,其精子数将达到3 亿~20亿。
通过改良的瑞氏-吉姆萨或者苯胺黑-伊红对精液 涂片进行染色(图5.149)可以检查精子的形态学特征。 薄的涂片瑞氏-吉姆萨染色需要5分钟,这种染色方法的 优点是除了精子细胞外体细胞也可以着染,另外还可以 将一滴苯胺黑-伊红和一滴精液混合置于载玻片上,让 着染细胞着色。
记录正常形态和异常形态精子的比例(图5.150和图 5.151),将异常的精子作为特异性的缺陷进行记录或者 通过分级缺陷较大/缺陷较小(表示生殖力缺陷)或者原 发/继发(表明缺陷的来源和位置)。异常头形、中心空 泡、双头、中段或者尾部结构异常、中段卷曲和近端出 现胞质小滴都是原发性的异常。继发性的异常包括末端 出现胞质小滴、头部分叉、直的尾巴、松散的或者分离 的顶体。还需要很多研究去确定哪些缺陷与犬的不育有 关。正常的精液中应该大于80%的精子形态正常。
使用瑞氏-吉姆萨或者新亚甲蓝对风干的精液涂片染色做细胞学检查可以鉴定和量化上皮细胞、炎性细胞 和红细胞。如果存在细菌的话可以通过革兰氏染色来鉴定。精液中的细胞起源于睾丸、排泄管道(附睾、输精 管、尿道)、膀胱、前列腺、尿道和阴茎表面。高数量的白细胞,尤其是毒性嗜中性粒细胞或者具有细菌吞噬 细胞表明与感染有关。巨噬细胞与尿道污染物没有联系,它一般与慢性感染有关。
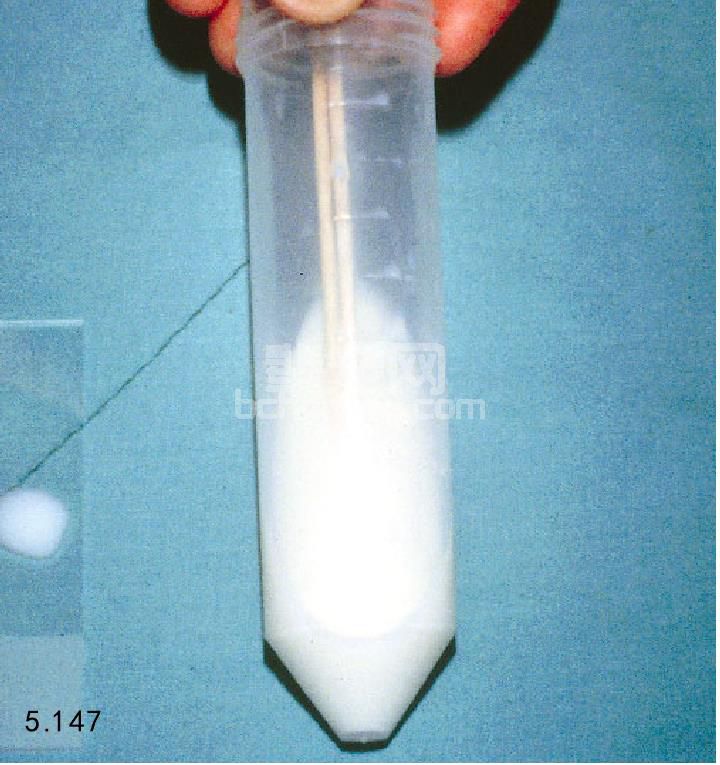
图5.147 评价精子的运动性,一滴(25μL)富含精子的精液滴在预热的载玻片上,盖上盖玻片,使用光学或者相差显微镜检查 (400×)。
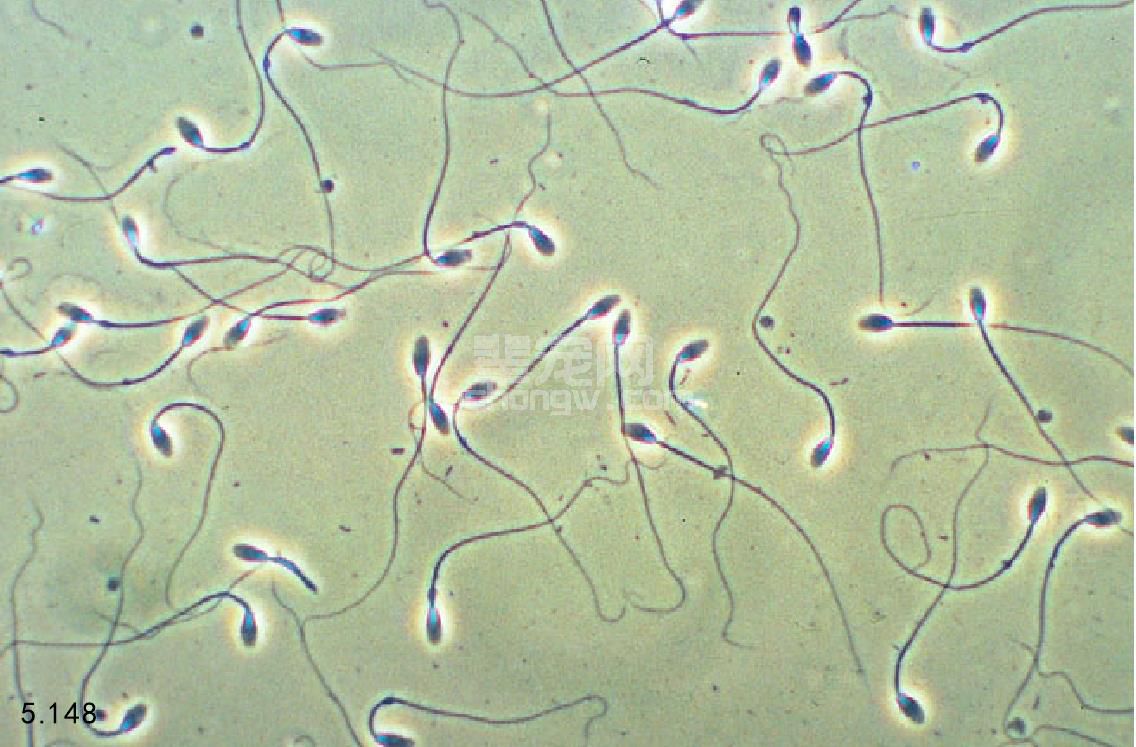
图5.148 记录前进直行的精子比例。

图5.149 混合阴性染料和一滴精液,在油镜的物镜下检查精子的形态 (1000×)。
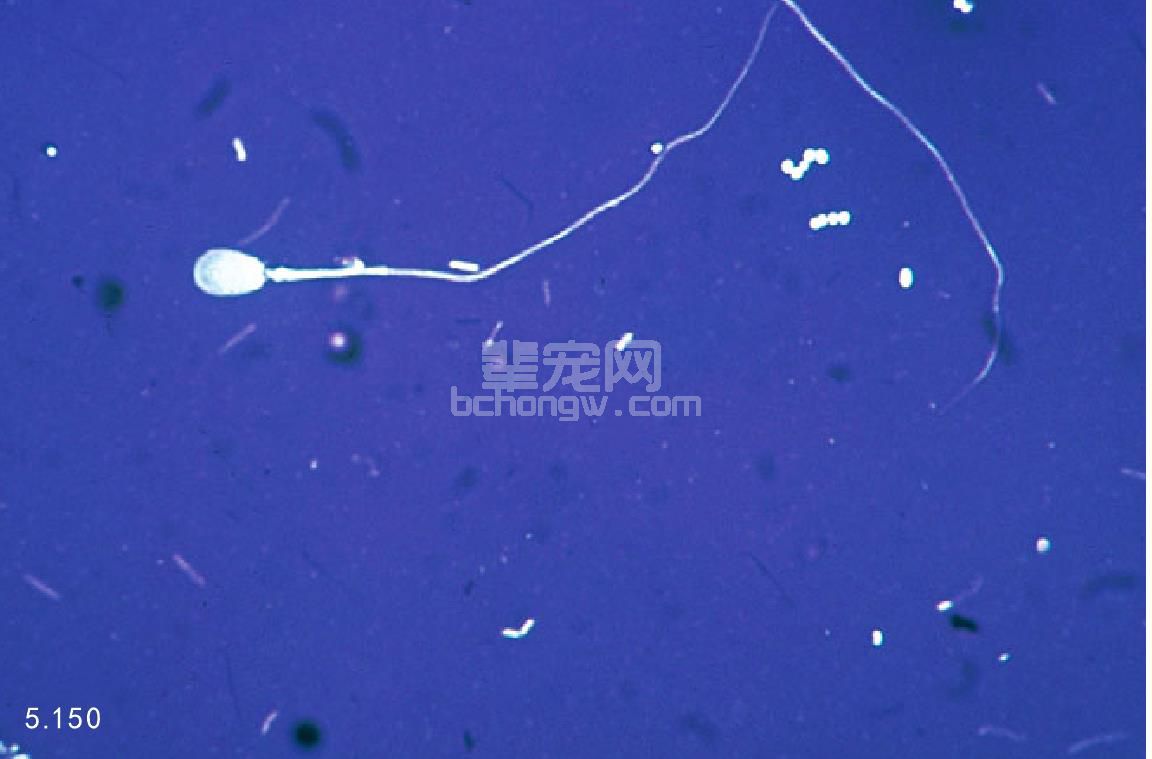
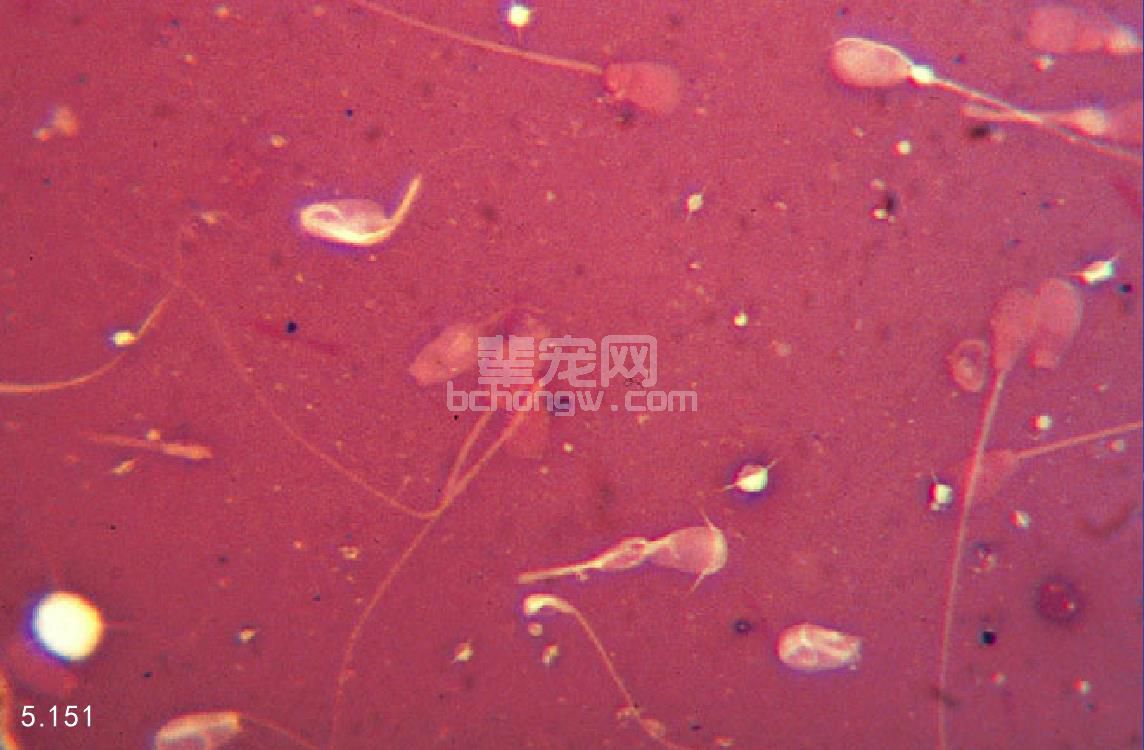
图5.150和图5.151 在对比染料的背景下对精子进行分类,正常(图 5.150);异常(图5.151)。
精液培养 对精液进行定量的需氧菌培养,每毫升精液中超过10000细菌可能表示有感染,革兰阳性菌在尿 道污染物中更常见,但是革兰阴性菌更能表示有感染。在雄性生殖道感染中厌氧菌的作用很小。如果怀疑有感 染,精液应该放到艾姆斯氏试验运输介质中以分离尿浆或者支原体。犬疱疹病毒的分离很少做。对于精液培养 和细胞学检查,最好分阶段收集精液以确定不同部位的感染。
内分泌学 正常的精子发生需要睾丸激素和FSH的相互作用,以及LH、催乳素、雄激素和局部分泌的一些 活性因子等都有作用。下丘脑分泌的GnRH能够刺激促性腺激素LH和FSH从垂体分泌。睾丸间质组织的间质细胞 对于LH有应答作用,能产生睾丸激素,睾丸激素能刺激青春期发育,维持成年动物的精子发生。睾丸激素还具 有负反馈促性腺激素释放的作用。FSH对于精子发生的开始是必需的,它可以作用于生精上皮中的塞尔托利细 胞。在FSH的影响下,塞尔托利细胞能产生抑制素、雄激素结合蛋白(ABP)、雌激素和其他物质。抑制素能负 反馈作用于垂体FSH、ABP与雄激素在睾丸中的转运有关。
诊断性内分泌学 睾丸激素对于维持正常的性欲和精子发生是必需的;然而,正常犬的变化水平很大,其 分泌量的波动在0.35~17 nmol/L之间,阉割后的浓度通常小于0.05nmol/L。睾丸激素通过刺激性试验很容易检测 (表5.53)。促性腺激素的分泌是阶段性的,因此检测FSH或者LH 时应该做3次,每次间隔20分钟。促性腺激素 一般不进行检测,因为它不是化验室日常的检查项目,但是它对于诊断精子缺乏很有意义。例如FSH被用作精子 发生的指示剂。在睾丸损伤时抑制素的浓度降低,随后FSH的浓度升高。正常犬的浓度范围在69~451nmol/L , 然而浓度大于867nmol/L可能表示睾丸受到损害。外周LH的浓度波动范围在1.75~35nmol/L之间。
精液碱性磷酸酶 精液AP的浓度是附睾射精的标记,并且有助于区别精子缺乏症和射精不完全。该酶来源 于附睾,在犬精液中以5 000~40 000IU/L的浓度存在。精液中AP的浓度小于5 000IU/L,则射精不完全或者双侧 附睾远端堵塞。
精子超微结构 怀疑超微结构有缺陷,可使用扫描或者透射电子显微镜检查(图5.152)。
附睾抽吸精子 触诊患犬一侧或者双侧附睾异常,或精液出现精子缺乏时可进行介入性操作。抽吸可显示是 否存在输精管阻塞性损伤、肿瘤、精子肉芽肿和附睾炎。对站立或者镇静犬,将其阴囊推向附睾尾部,使用无 菌的22~25穿刺针抽吸附睾内容物。显微镜检查抽吸物可以看到精子、炎性细胞或者细菌,在操作中发生精子 溢出会导致精子肉芽肿。
表5.53 外周血清激素浓度与生殖系统的关系 *

注: * 竞争性试验包括给予GnRH(犬,2μg/kg,肌肉注射;猫,25μg/只,肌肉注射)或者hCG(犬,20 IU/kg,肌肉注射;猫,250 IU/只,肌肉注 射),4小时后测定睾丸激素。竞争后结果会超出竞争前的水平。
睾丸穿刺 睾丸穿刺有助于提供病因学和睾丸损伤严重程度及预后依据(图5.153)。患有精液减少或精子 缺乏犬,以及检查精液时精子显示有原发性形态异常时可进行睾丸穿刺检查。该项操作要在全身麻醉情况下进 行。阴囊消毒,通过细针抽吸或者楔形切除术获取组织。后遗症如出血、粘连、炎症和局部自身免疫反应等常 见。组织样本经过Zenker’s 或者Bouin’s液固定之前可进行培养,固定后的组织进行组织学检查:生殖细胞和塞 尔托利细胞出现、幼芽上皮细胞增殖和成熟、生精管腔中存在精子、存在正常莱迪希细胞的组织结构。定量测 定,如生殖细胞和塞尔托利细胞的比率、生精小管的直径、成熟生殖细胞的鉴定,可以更准确地说明睾丸的病 变程度。
染色体组型 雄性犬和猫的睾丸发育不全或先天萎缩、异常的外部形态或者其他的雌雄同体的症状都可能与 染色体组型有关。进行细胞遗传学实验需要肝素抗凝的新鲜全血。
骨盆和腹腔的X线照相和超声波检查 超声波检查可以提供有关睾丸(图5.154)和附睾损伤与否及肿瘤、睾 丸不下、睾丸扭转、腹股沟疝和前列腺的疾病(图5.155和图5.156)。超声波检查还可以用于前列腺穿刺针活组 织检查和抽吸的监视。X线片有助于诊断腹腔后部的前列腺疾病。
微生物分离 支原体和尿浆有时可以从精液中或者从包皮以及尿道的擦拭物中分离培养。这些病原体与生殖 道疾病的联系尚未确定,在一些能够生育的犬身上也能分离到。单纯培养不能确诊,只有与细胞学检查和临床 症状结合才能显示感染。
其他的诊断方法 其他试验可检查精子的结构和功能:包括膜完整性试验、宏观细胞结构和完整性(图 5.157)、卵母细胞和输卵管的结合能力、计算机辅助分析精子运动模式和形态学变化。试验参数很少与雄性犬 和猫的繁殖有关。
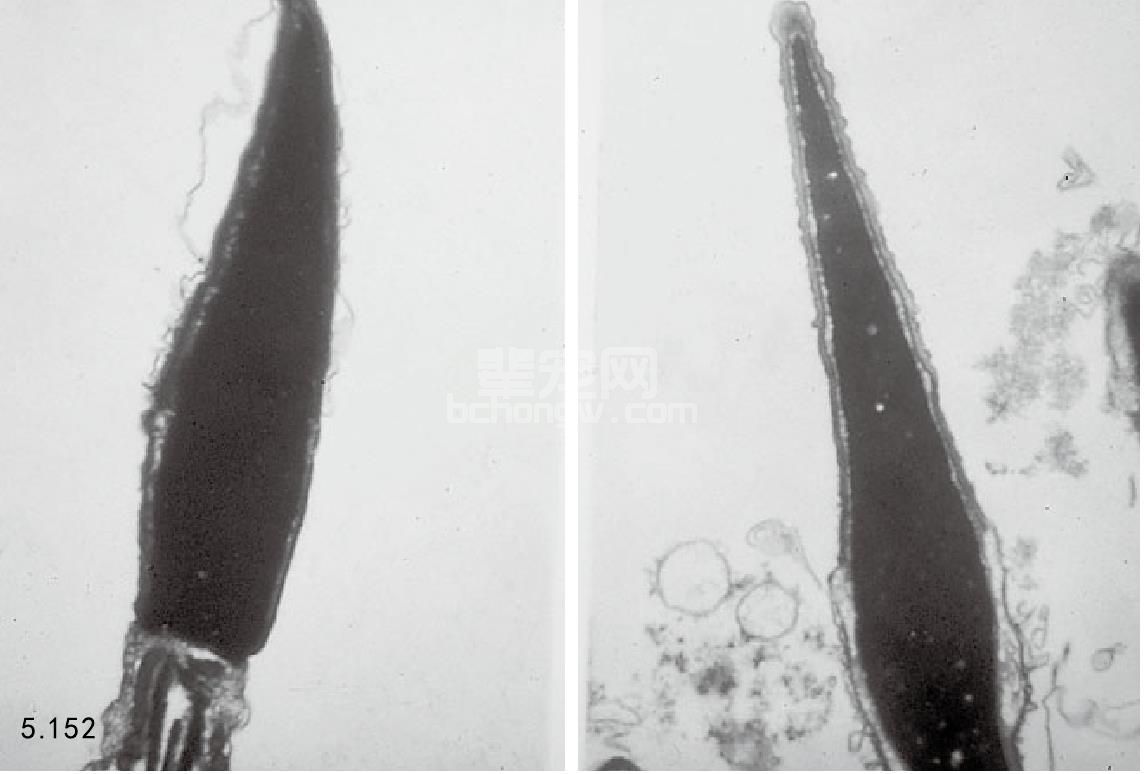
图5.152 电子显微镜图像显示了存在(左侧图)和不存在浆膜的精子(右侧图),缺少浆膜的精子是细胞膜的缺陷之一,右侧图在显微镜下观察不 到,但是在电子显微镜下显示得很清楚。
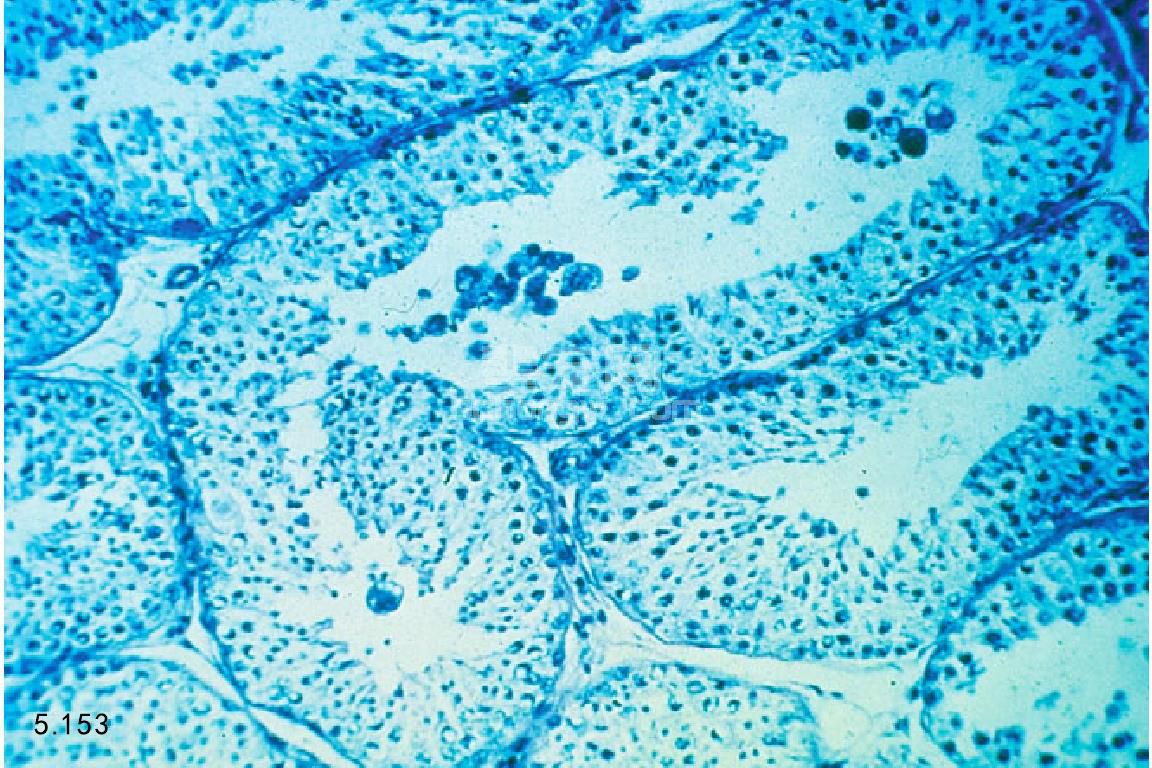
图5.153 犬的睾丸穿刺显示缺少活性精子的生成,但是生精上皮细胞完整。
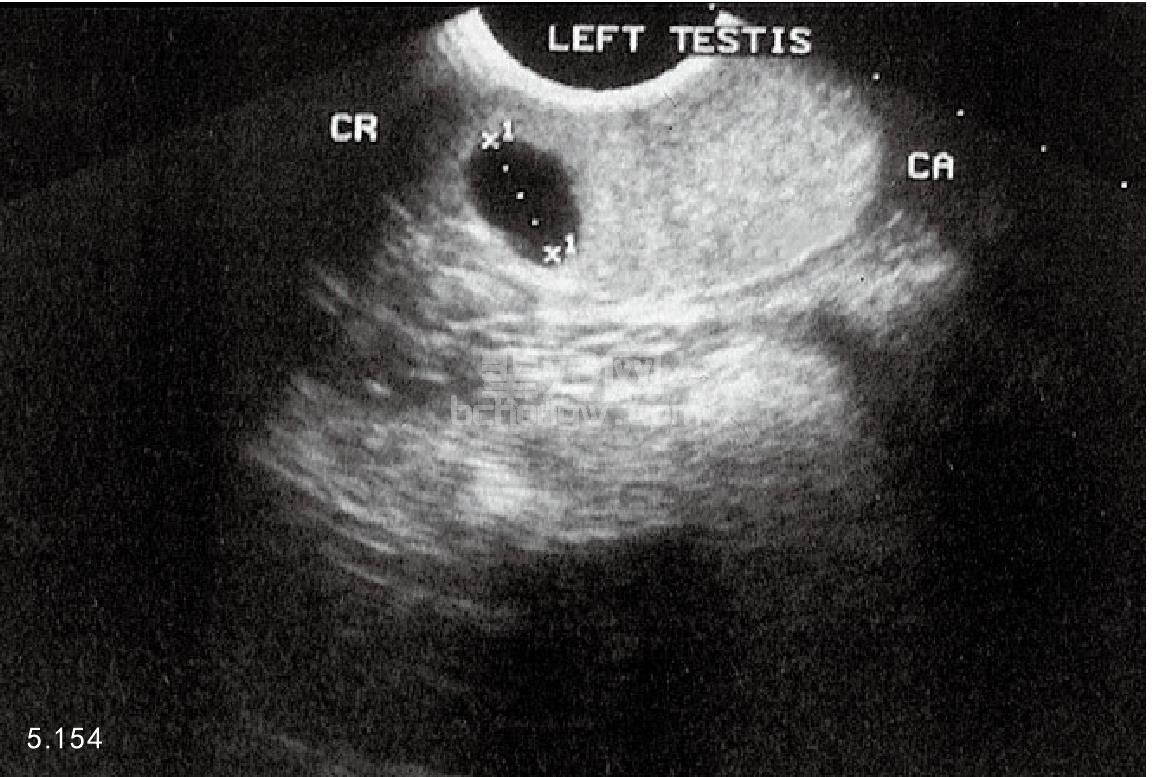
图5.154 超声检查犬的睾丸,在睾丸头部(CR)邻近附睾的位置出现空洞损伤。该病灶是塞尔托利(Sertoli)细胞肿瘤,可以做单侧睾丸切除术。
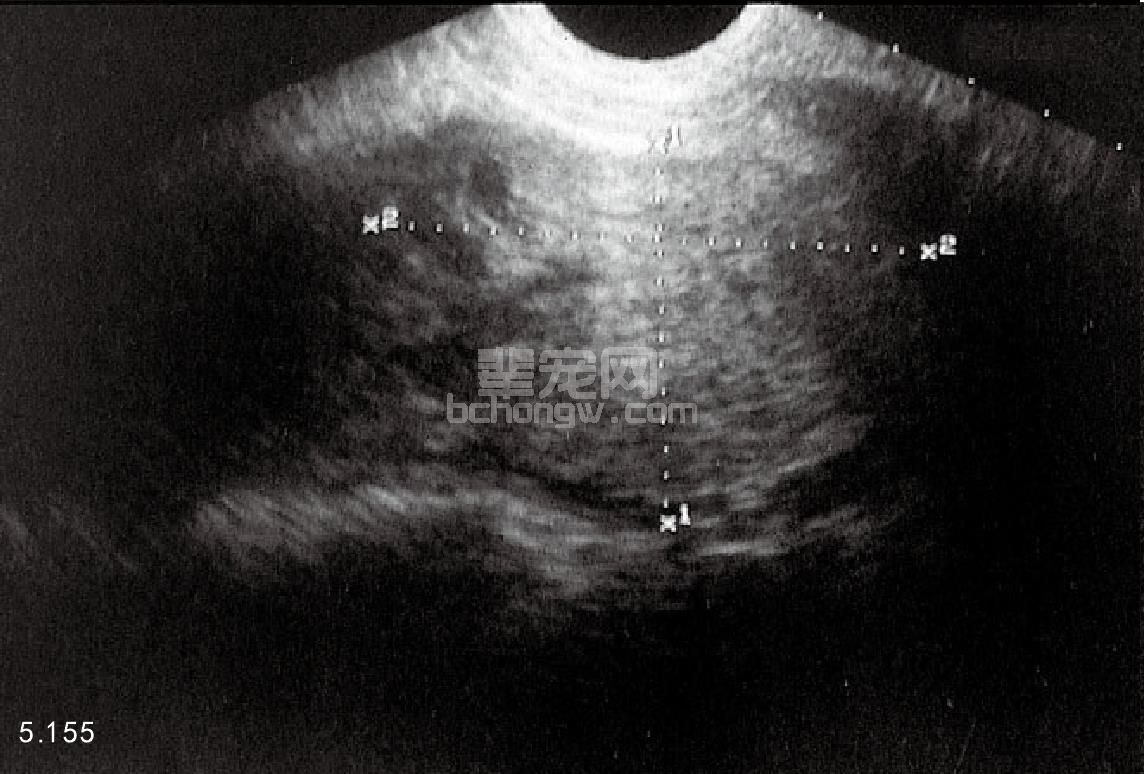
图5.155 澳大利亚牧羊犬的横腹位超声图像,右半侧的前列腺增大聚集性囊状结构。
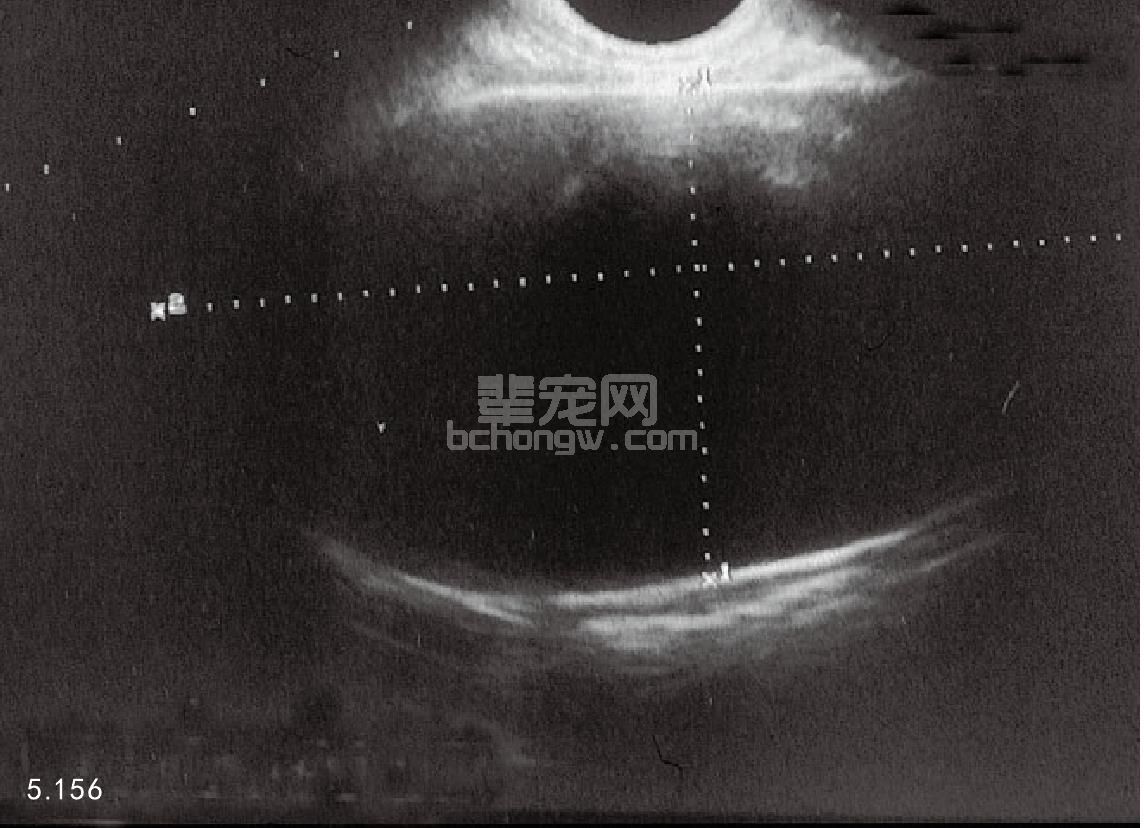
图5.156 巨大的前列腺实质囊肿,紧邻左半侧前列腺。
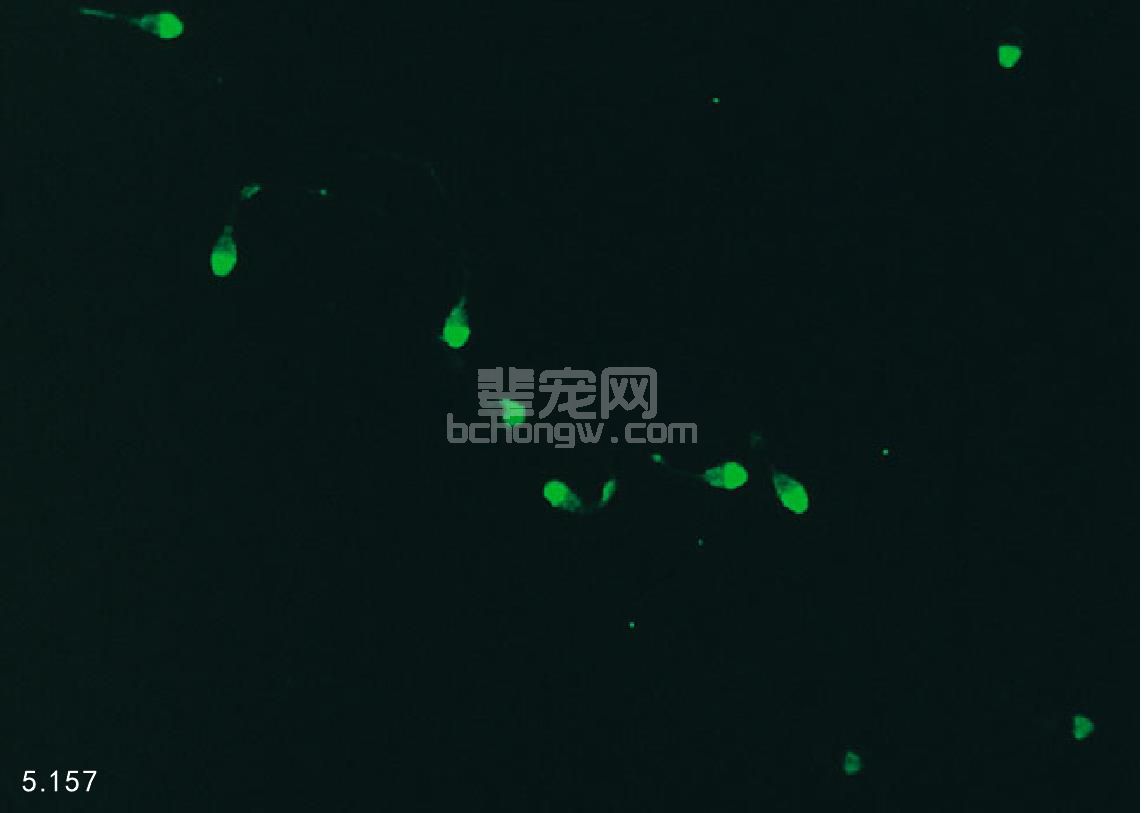
图5.157 表面荧光显微照片显示宏观细胞完整性。