犬软组织肉瘤治疗原则
软组织肉瘤由多种间质组织发展而来,但它们通常被作为整体进行考虑,因为其临床表现和组织学特点相似。这些肿瘤侵袭局部,难以界定其组织学边界,肿瘤细胞常常通过筋膜面向下浸润。通常保守性切除后,局部复发很常见。治疗前活检可以提供肿瘤类型和分级的信息,让临床医生可以适当的计划积极的第一次手术。效仿人类医学,犬组织病理学分级系统有其预示性。尤其是,有丝分裂速度预示的转移,坏死和有丝分裂速度预示的生存期限。诊断性影像在确定病变范围和治疗计划中有其作用。软组织肉瘤最有效的治疗方法是手术切除。根治目的的手术要求术前活检、计划以及大范围的第一次切除。手术越来越多的被多方式治疗取代。放疗在软组织肉瘤管理中起到重要作用,但是如果作为单一治疗方法使用,效果却非常有限。放疗适用于不完全切除的肿瘤,或术前治疗。化疗的主要作用是辅助治疗,主要用于治疗不完全切除的肿瘤,高等级肿瘤和转移性疾病。
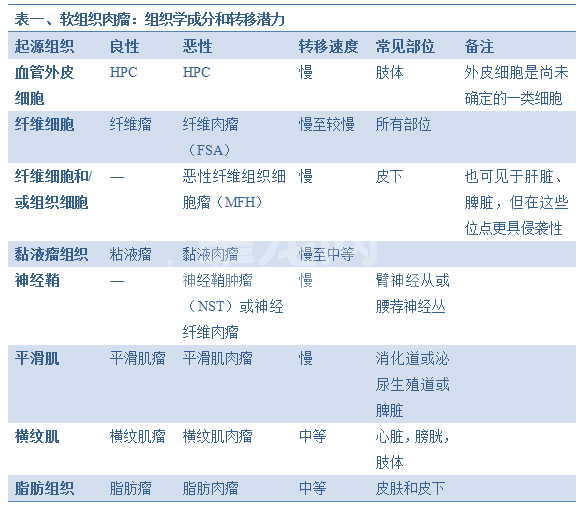
绝大多数软组织肉瘤(STSs),但并不是所有,由多种间质组织发展而来,但它们常被作为整体考虑,因为其临床表现和组织学特点相似。软组织肉瘤是骨外的和非上皮性的。肿瘤起源于中胚层,即胚胎三个原始胚层的中间一层。中胚层衍生出结缔组织、骨、软骨、肌肉、血管和淋巴管。软组织肉瘤可以从任何解剖学位点发展而来,并根据其类似的组织进行分类(表一)。有一种肿瘤,即神经纤维肉瘤,是例外,它起源于原始外胚层。它被包含到这一组是根据其生物学行为的相似性。肉瘤和癌的区别在于肉瘤起源于结缔组织,而不是上皮组织。
软组织肉瘤是由假包膜包裹,包含着被压缩但是具有生存能力的肿瘤细胞。这些肿瘤侵袭局部,很难辨认其组织学边界和通过筋膜浸润的肿瘤细胞。保守性切除后局部复发一般很常见。当软组织肉瘤发生转移,转移多为血原性的,典型转移至肺脏和肝脏。与之相反的是,局部淋巴结转移并不常见。据报道其转移率低。在Kuntz对于75只犬的研究中,转移率为17%,转移的中位时间为365天。在转移的多元分析中,只有有丝分裂速度具有显著的预后不良性。2000年,McKnight等观察到了更低的转移率(8%,4/48只犬),所有的转移均为肺部转移。转移会显著减少生存期(ST);转移的中位生存期为250天。与之相反的是,超过75%的无转移患犬,能活到5年。
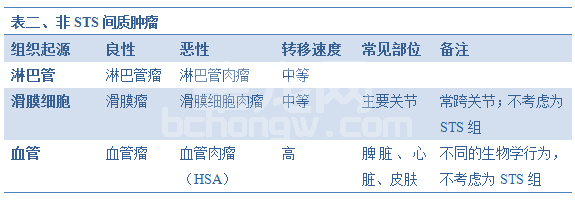
间质肿瘤,如骨肉瘤、软骨肉瘤、滑膜肉瘤、血管肉瘤和淋巴肉瘤都被典型地排除在外,因为它们转移率高。这些肿瘤并不包括于本讨论中(表二)。
病史和临床症状
绝大多数软组织肉瘤患犬都较老,有缓慢生长、无痛感的肿块。软组织肉瘤可以出现在身体任何一个位置,从头到脚,包括实质器官。临床症状各异,取决于病灶所在的不同解剖位置。临床症状与位置、大小以及具体的侵袭有关。虽然软组织肉瘤常为坚实固定的,它们也可能是柔软的、分叶状的,大体观可能与良性脂肪瘤混淆。常见的解剖位置包括在表一中
平滑肌肉瘤在消化道、泌尿生殖道或脾脏常见。这些患犬可能表现出厌食、消瘦、呕吐、腹泻和黑粪。涉及膀胱的横纹肌肉瘤会导致下泌尿道症状,如尿血、痛性尿淋漓和排尿困难。涉及臂神经丛或腰荐神经丛的外周神经鞘瘤可以导致疼痛、跛行、肌肉萎缩和瘫痪。
诊断和分期
有可疑肿物的患犬应该接受活检,尤其是肿物最近发生了变化或患犬开始出现症状时。特别要注意不能妨碍之后的根治性切除,要保持组织层面完整。组织病理学分级和临床分期对于适当的治疗方案和预后极其重要。确诊必须进行活检和组织病理学评估。活检应进行计划,做到活检通路在最终治疗中可以进行处理。活检计划时应做到该通路能在手术时轻松切除,或包括在放疗范围中。活检方法包括针刺活检、钻孔活检、切开或切除活检。切除活检的缺点是经常不是治愈性的。想要得到清洁边缘二次手术可能比一开始就确定的治疗更具挑战性,需要更大范围的切除。因此,活检应当在以治愈性为目的的手术之前进行。
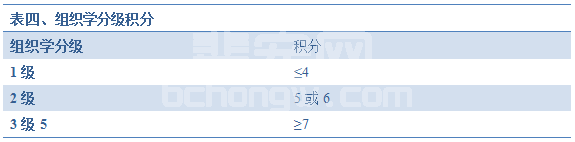
活检会提供肿瘤类型和分级的信息,使临床医生可以合理的制定积极的第一次手术。病理学家通常在综合考虑分化程度、10个高倍视野的平均有丝分裂相数目和坏死数量(表三)后得出肿瘤分级。在各种分类中,会得到一个分数。累积的分数转换为一个等级(表四)。因此,分级随着这些特征的相应频率而增加。犬的组织病理学分级系统源自人类医学,在人类可以预测生存期。在犬,有丝分裂速度预示转移,坏死和有丝分裂速度预示生存期。

细针抽吸细胞学可用于排除其他非肿瘤性鉴别诊断,例如脂肪瘤、血清肿、炎症或脓肿。细胞学还可以确定其他肿瘤,例如淋巴瘤、组织细胞瘤和肥大细胞瘤。但是,细胞学在确诊肉瘤时有其局限性。肉瘤不易脱落,坏死部分和反应的组织可能导致误诊为炎症。
体格检查不一定表明肿瘤涉及的完整范围,可能在可触摸肿物的表面延伸出指状的突出。局部淋巴结应进行触诊。虽然淋巴结转移并不常见,但是在分期程序中应该包括淋巴结细针抽吸。淋巴结细针抽吸侵略性最小,而且局部淋巴转移的出现将会改变预后和治疗计划。最基本的数据(全血计数、生化和尿检)通常没有明显异常,但是可能提示并发症或副肿瘤综合症。有报道称副肿瘤性低血糖发生于消化道、肝脏和脾脏平滑肌瘤和平滑肌肉瘤。
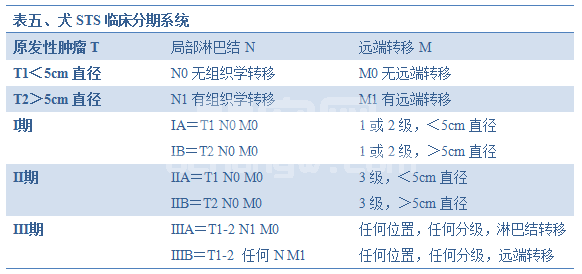
诊断性影像可用于确定疾病的范围和治疗计划制定。如果肿物接近骨骼,应该拍摄放射线照片以确定骨骼的涉及情况。造影剂增强性计算机断层X线扫描术或核磁共振成像将利于更好的手术和放射计划。这些先进的成像技术通常证明切除是不可能的,需要进行辅助治疗。告知主人预期结果很有用。确定治疗前应拍摄胸腔X线照片(3-视角),以评估肺部转移情况。腹部超声或电脑断层扫描用于指示原发性腹部病变或评估肝脏或其他腹腔转移。这一临床分期系统见于表五。
治疗
手术
STS最有效的治疗方法是手术切除。治愈性手术要求术前活检、计划和大范围的首次切除。之前讨论的影像诊断利于更好的手术计划制定。有经验的外科医生将更倾向于积极的方法,使边界干净。相反,保守性切除会产生不彻底的边界,常见复发。外科医生应该切除肿瘤周围3厘米的边界和筋膜面下方。不能破坏肿瘤的包膜,否则会留下残余的组织。在四肢很难甚至不可能达到边界。可能会需要截肢术,尤其是术后难以进行放疗等辅助治疗时。活检部位必须包括到切除范围中。金属的标记物,如止血钳或不锈钢丝线在放疗肿瘤学医生判定肿瘤体积时非常重要。切除后,缝合手术切口时手术手套和器械应该更换,以避免在这些部位接种恶性细胞和散播肿瘤细胞。
应该将整个样本给予病理实验室。就算之前做了术前活检,不给予样本仍然不合适。不给予整个样本同样不合适。最后,组织学诊断时不要求附上显微镜描述也不合适。手术边界应该进行标记,以帮助病理学家确定边界。任何方法都可以。可以使用不同的颜色,或者放置缝线。
一项涉及75只患犬的STS研究显示,肿瘤边界切除的完全性可预测局部复发的可能性。未完全切除的患犬局部复发的概率约为完全切除的10.5倍。总体上,复发率为15%,中位复发时间为368天。相对的,边界不干净的患犬复发率为28%(36只中的10只)。中位生存期为4416天(3.9年)。之后会进行讨论,分级是转移和整体存活的重要预后因子。
如果不能切除到至少显微镜不可见,那么就应该质疑推荐的积极切除的作用了。治疗显微镜可见级别的肿瘤,放疗和化疗是最有效的。而肉眼可见的肿瘤,则很难做到长期控制。
放疗
逐渐的,手术被联合治疗替代。放疗在STS的这一治疗中起到了重要的作用,但是单纯的放疗效果则非常有限。含氧量低的位置发生肿瘤,而肿瘤的低含氧量是产生抗放疗性的主要原因。通常大块的或可测量的肿瘤放疗效果差,而治疗显微镜级别的病变时放疗是最有效的治疗方法。一些主人会选择放疗和手术联合治疗肢体STS,而不是截肢术。主人应该知道双重治疗的失败风险较大,之后如果复发,可能还是会建议截肢术。
因此,放疗适用于不完全切除肿瘤或术前治疗。在术前,放疗是对抗显微镜级别病变最有效的方法,而且将杀死外周的肿瘤细胞,增加完全切除的可能性。目前尚没有研究显示术前或术后的放疗是否会有更好的反应率,更好的局部控制率或更少的并发症。通常情况下,建议术后3—4周再开始放疗,以便切口组织愈合。
在一项涉及42只仅由兆电子伏放疗治疗患犬的研究中,一年的治疗达到了一个可以接受的局部控制率。45和50盖伦(Gy)剂量下的控制率分别为48%和67%。但是长期控制效果差;2年时50Gy的控制率下降至33%。相对的,48只患犬联合了手术和放疗(目标剂量为63Gy)的长期结果更好。在这项研究中,年龄和存活呈负相关,但分级并不是复发或存活的显著预后因子。整体中位无病期(DFI)为1082天,8只局部复发(16%复发率)。中位复发时间为700天,而复发和存活之间有很强的联系。24只局部复发的患犬中位生存期(ST)为1341天。没有患犬出现转移和局部复发。存活率如下,1和2年为87%,3和4年为81%,5年为76%。最后,57盖伦,每次3盖伦治疗的37只患犬的中位生存期为1854天(5.1年)。复发率较高(31.4%),复发的中位时间长于798天。口腔部位与存活预后较差有关。
最佳的总放射剂量和分次计划还没有确定。目前,绝大多数放疗肿瘤学医生推荐确定性治疗,持续的每日(周一至周五)治疗。分次小剂量可改善肿瘤反应,而且对正常组织伤害较小。从放疗的角度,可以通过分次小剂量得到更高的累积剂量,而且得到更好的肿瘤控制。
化疗
通常STS对化疗反应差。化疗最适合辅助治疗并主要用于治疗未完全切除的肿瘤,高分级肿瘤和转移性肿瘤。使用化疗治疗不可切除肿瘤是一种姑息治疗。含多柔比星的治疗方案和米托蒽醌对抗STS最有效,据报道反应率约为20%。绝大多数情况下,多柔比星单独使用或与环磷酰胺,或长春新碱及环磷酰胺(VAC疗法)联合使用。经常推荐化疗治疗3级STS,以尝试阻止或延迟转移。目前尚缺乏证明其有效性的目的研究。
预后因子
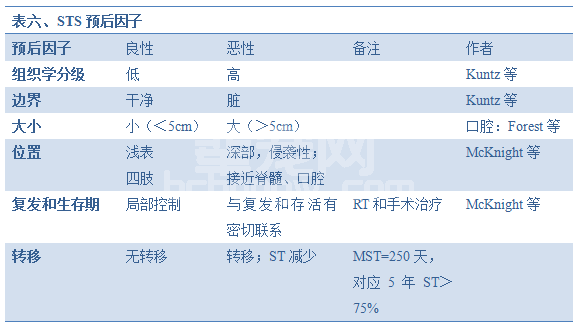
目前,组织学分级被认为是犬STS最一致的预后因子。研究显示分级是转移和整体存活的重要预后因子。在Kuntz1997年的研究中,有丝分裂速度、分化程度、组织学类型和整体分级在单变量分析中可显著地预测转移。坏死百分比和有丝分裂速度对生存期有预测性。坏死>10%的患犬死亡的可能为2.78倍,而且每10个高倍镜视野下≥20个有丝分裂相的患犬死亡的可能为2.56倍。这些结果强调了病理报告中显微镜描述的价值。完全切除的肿瘤边缘也可预测局部复发。因此,鉴定和评估边界是病例管理的首要任务。表六为预后因子总结。
目前,STS免疫组化的常规应用还很有限。在兽医中心,我们目前评估了AgNOR(嗜银性核仁组织区),PCNA(增殖细胞核抗原)和Ki-67是否与STS患犬的组织学分级和预后相关。初步的分析显示,Ki-67和分级及转移之间有正相关关系。
根据我们的数据,存活的不良预后因子包括高组织学分级、高AgNOR计数、高Ki-67和高有丝分裂计数。似乎使用非形态学因素,如这些增殖标记物,将提高诊断的特异性,并提供更多地预后信息。
比较学
相比而言,人类和犬的STS有相似的病理学表现、临床症状和行为。肉瘤是相对比较少的间质肿瘤,为偶发。与动物比较起来,年轻人的发病率较高。特定的发病率根据STS的类型变化。在人类,纤维肉瘤、淋巴肉瘤、横纹肌肉瘤、恶性纤维组织细胞瘤和滑膜肉瘤更常见。常发部位相似,四肢是最常见的发病部位。在人类转移更常见,50%的STS患者将因为远端转移死亡。相较于人类,在犬有更多地神经鞘肿瘤,其转移率低。在人类医学,预后变量已确定,包括位置、手术边界、大小、临床分期、组织学分级、转移和手术或放疗的积极性。
目前,人类和犬的STS的诊断金标准为形态学。提出了许多组织学分级系统并应用于人类STS,而且在许多研究中,组织学分级已经被证明是STS最有利的独立预后因子。正如之前提到的,组织学分级系统已被证明对存活有预示性,并用于犬。非形态学因子的研究将使诊断和分级更容易,其提供了更多地STS生物行为信息。人类STS患者,如P53、细胞周期蛋白、细胞周期蛋白激酶抑制因子、银染核仁形成区和Ki-67已被证实有预示性。
