电针对椎间盘脱出模型大鼠脊髓巢蛋白和音猬因子变化的影响
摘 要:近些年来人们对精神生活的追求不断提高,饲养宠物的家庭越来越多,椎间盘脱出症同样也是宠物临床上的高发病。目前治疗椎间盘脱出症的主要方法有使用药物的保守疗法,外科手术疗法和电针疗法,其中电针显示出神奇的疗效。但电针的作用机理复杂且不明确,其相关研究对电针在临床上的普及具有重要意义。
本研究通过制作大鼠椎间盘脱出模型观察第4、7、14 d压迫部位脊髓组织Nestin表达和SHH含量的变化及电针对其影响,探究电针激活神经干细胞,升高正常神经元数量改善运动机能的分子机制,为电针治疗椎间盘脱出症提供试验依据。
1.概述
1.1 椎间盘脱出症概述
椎间盘是由位于中央的髓核和位于周围的纤维环构成,椎间盘脱出症是指纤维环破裂,髓核脱出压迫脊髓或神经根,主要表现为肢体疼痛、冰冷、麻木、跛行甚至瘫痪,并时常伴有大小便不能自主,严重危害人类和宠物的健康。病因大致可以概括为三类:一遗传因素,多见于腊肠犬和京巴犬等,因患软骨营养障碍在幼年时发生髓核脱水和变性,对外界刺激的缓冲性较低;二外力、运动不当、气温突变和营养失衡等因素均是导致椎间盘脱出的可能原因;三老年退行性变,主要表现为随着年龄增长功能减退并发纤维环增生变性甚至破裂。椎间盘脱出症目前是宠物临床上的高发病,统计显示66-88%发生在椎管管径最为狭小的胸腰部,患遗传性软骨营养障碍的犬发病率为60%。
目前临床上西医有时采用类固醇和非类固醇类抗炎镇痛药保守治疗[1] ,但此方法仅能暂时缓解疼痛,有时因短暂镇痛导致宠物无法静养甚至加重病情。较常用的是通过外科手术的方法[2] 将脱出的髓核取出,对脊髓减压从而治疗原发性损伤,但继发性损伤并未得到改善。电针疗法可以在压迫存在的情况下改善脊髓微循环治疗继发性损伤,既避免了保守疗法治标不治本的缺点,又避免了手术疗法创伤大、术后恢复时间长的缺点,对急性和慢性病例均具有显著疗效。据统计电针治疗Ⅳ级犬椎间盘脱出症,有93%以上的病例可以在2周内恢复行走,45.5% [3,4]发病超过48 h的病例可显著恢复运动机能。
椎间盘脱出症导致的脊髓损伤分为原发性和继发性两个阶段,脱出的髓核压迫脊髓导致的物理性损伤为原发性损伤;脊髓受压后微循环稳态失衡导致脊髓的继发性损伤,例如局部缺血缺氧、血液粘稠度上升[5,6]、氧自由基和大量炎症因子生成释放和离子通道紊乱导致微循环血流灌注量显著下降、大量神经细胞变性坏死、星形胶质细胞瘢痕化、轴突数量减少脱髓鞘等,所产生的脊髓损害是不可逆的[7]。
1.2 巢蛋白和神经干细胞研究进展
传统观点认为神经系统分化成熟后神经元一旦坏死便无法再生,直到神经干细胞成功体外分离培养及巢蛋白(Nestin)概念的提出改变了神经系统无法再生的理论。1985年,Hockfield 和Mckay首次发现Nestin[8],Nestin是细胞质中第Ⅵ类中间丝蛋白[9],在神经干细胞中呈一过式表达构成其骨架,也是神经干细胞的标志分子,可以被抗大鼠Nestin单克隆抗体特异性识别。胚胎期神经干细胞增殖,Nestin表达,随着机体发育成熟一部分神经干细胞转为休眠状态,Nestin停止表达;一部分神经干细胞在机体发育过程中迁移分化为神经元和神经胶质细胞后,Nestin被其相应的中间丝标志物取代(神经丝蛋白和胶质纤维酸性蛋白[9])。机体发育成熟后当神经系统受损或患肿瘤性疾病时,神经干细胞被激活,Nestin再次表达。
神经干细胞是一类具有分裂潜能和自我更新能力的母细胞。分裂方式有对等分裂和不对等分裂,通过对等分裂可以产生两个新的干细胞,通过不对等分裂产生一个祖细胞和一个新的干细胞。祖细胞自主分化为神经元、星形胶质细胞和少突胶质细胞,并且在外界的刺激下可以自我更新产生新的神经干细胞,在脊髓损伤修复中起关键作用。1992年,Reynolds等[10]首次从成年大鼠脑组织中分离培养出具有分化潜能的神经干细胞,随后进一步分离已经发育成熟的哺乳动物脊髓神经干细胞,鉴定的方法即为特异性标记Nestin。谭波涛等[11]给大鼠脑室内注入荧光标记物,之后通过制作脊髓损伤模型的方法观察到了免疫荧光阳性细胞,证实了存在被激活的内源性神经干细胞。
随着科技的发达,有学者尝试给脊髓损伤大鼠移植间允质干细胞,观察到大鼠的运动机能有所恢复,但干细胞移植后所处的微环境对其存活增殖迁移分化影响很大,其中只有极少量的干细胞存活下来,而电针可以改善微环境为神经干细胞的存活和分化提供有利条件。
1.3 促神经元生长相关因子的研究进展
音猬因子1978年,Lewis[12]在筛选突变体时发现了一种基因,此基因突变时无毛的果蝇会长满短刺,极像刺猬,因此给此基因命名为刺猬。果蝇只有一种刺猬因子,而人类有三种分别为沙漠刺猬因子、印度刺猬因子和音猬因子(Sonic hedgehog Homolog,SHH)。音猬因子是形态发生素,促进神经干细胞向神经元分化,为神经元再生提供有利条件。三种因子中音猬因子信号通路是研究最透彻的,有研究表明阻断SHH信号通路脊髓腹侧运动神经元全部消失,抑制其通路导致神经干细胞凋亡,激活其通路提高神经干细胞向神经元方向分化比率[13,14]。有研究表明SHH的浓度可以影响脊髓腹侧各类神经细胞的分布位置,因为在胚胎发育过程中SHH由脊索和底板细胞合成并向外扩散分泌形成逐渐降低的浓度梯度,诱导神经前体细胞向不同的神经细胞分化[15,16]。
1.4 电针治疗椎间盘脱出症的研究进展
针灸作用于体表穴位,主要是通过调动和调节机体固有机能而发挥作用。传统医学理论认为“凡病皆因气血壅滞,不得宣通,针以开之…”,即气滞血瘀是疾病的基本病因病机,活血化瘀是针灸作用的传统机制,主要通过“通经活络,活血化瘀,调节气血”发挥治疗效应。针灸和中药是中医和中兽医防治疾病的主要手段,由于针灸独特的作用和疗效获得临床患者广泛的认可,在动物疾病防治中同样发挥着重要的作用。随着医学进步,电针、激光、水针等诸多现代针灸技术在临床得到广泛引用,而针灸的作用机理也逐渐被学者关注和重视。
椎间盘脱出症传统中兽医学称之为痿症,是危害人类和动物健康的重要疾病。黄帝内经上写到:肺主身之皮毛,心主身之血脉,肝主身之筋脉,脾主身之肌肉,肾主身之骨髓。肾气热,则腰脊不举,骨枯而髓减,发为骨痿。中兽医学认为外力损伤、感受风、寒、湿邪致气血壅滞不通;先天不足或后天肾气虚弱导致骨萎,少髓;饲喂不当;过度应激损伤脾气致肌肉萎缩、四肢无力;肝血不足导致筋、爪失养是该病的主要病因病机,而脊髓气血不足或气滞血瘀是该病所致痿症的基本病因。电针治疗瘫痪在人类医学界早有应用并且具有显著疗效[17,18,19]。现代研究证明,针灸作用广泛,涉及神经、内分泌、抗炎、血流动力、血液流变、甚至基因表达调节等诸多方面[20]。针灸具有改善血液循环[21],降低血液粘稠度[22,23]等活血化瘀作用。
近年来,电针治疗椎间盘脱出症的作用机理成为学者的研究热点。通过多年的研究总结电针的作用机理大致分为四个部分:控制和改善继发性损伤、促进轴突再生、减少细胞凋亡和促进细胞新生分化。
刘长发等[24]试验证明电针能明显降低脊髓受压部位血栓素TXA2和TXB2含量,抑制血小板聚集减少血栓形成,减轻血管收缩改善微循环。张尧[25]试验证明电针升高抗氧化酶的活性对抗过多的氧自由基减轻脂质过氧化,从而控制继发性损伤。李志刚等[26]试验证实电针治疗脊髓损伤时能显著降低细胞内Ca2+浓度,减轻因钙离子细胞内聚集导致的血管痉挛和缺血。还有学者研究发现电针“百会”能显著降低iNOSmRNA和nNOSmRNA的表达,升高eNOS的表达,减少NO的产生,改善细胞膜的通透性调控血脊髓屏障的开放[27]。张莹莹等[28]进一步研究证明电针可以减少白介素-1α在细胞中的表达,也有学者试验证明电针可以减少血清中肿瘤坏死因子-α的含量,有助于减轻脊髓的炎症反应。
汪吉明等[29]试验证实电针可以促进神经特异性磷酸蛋白的表达,参与轴突发育和神经细胞再生。赵伟等[30]试验证实电针可以抑制硫酸软骨素蛋白多糖的表达,减轻胶质瘢痕化,有利于轴突再生重建神经回路。乔鸿飞等[31]用免疫组化的方法证明电针可以促进损伤脊髓表达神经丝蛋白,促进轴突轴牙再生。
上官豪等[32]研究发现电针曲池、足三里穴可通过线粒体caspase-3途径抑制缺血周围区皮质神经细胞凋亡。徐维蓉等[33]试验表明电针可以升高脊髓损伤部位内源性应激蛋白的表达,保护损伤后的神经细胞为运动机能的恢复提供有利的前提。反应性星形胶质细胞增生是脊髓损伤的愈合反应,表现为纤维型星形胶质细胞增生,最后成为胶质瘢痕[34,35,36]。胶质瘢痕化的最后阶段是凋亡的细胞被大量纤维细胞代替最终失去生理功能。
综上所述电针通过多种方式减轻脊髓损伤,促进脊髓修复,为机体运动机能恢复提供有利条件。但其促进脊髓神经细胞修复的分子机制尚不清楚,电针是否通过影响巢蛋白和音猬因子的变化从而影响神经干细胞的增殖和分化以及神经元的再生需要进一步研究。
2.材料与方法
2.1 主要仪器与试剂耗材
种植机(NSK, Surgic XT);电针仪(北京欣东华电子仪器有限公司,WQ-6F);针灸针(苏州天协针灸器械有限公司,2×25mm);焦油紫(Sigma,MKBR9934V);Rat Hedgehog Homolog,Sonic ELISA试剂盒(MyBioSource,L150325642);FITC标记山羊抗小鼠IgG(H+L)(Beyotime Biotechnology,A0568),抗大鼠巢蛋白单克隆抗体(abcam,ab6142)。
2.2 实验动物及分组
雄性SD大鼠39只,购自中国人民解放军军事医学科学院实验动物中心[SCXK-(军)2012-004]。体重160~170g,随机分为空白组(n=9)、模型组(n=15)和电针组(n=15)。
2.3 大鼠椎间盘脱出模型的建立和穴位选取
腹腔注射戊巴比妥(50 mg/kg体重)麻醉大鼠,在第一腰椎棘突背正中线部位剃毛、消毒,做2 cm切口切开皮肤,皮下筋膜,皮下脂肪,剥离背最长肌和多裂肌,用咬骨钳咬掉L1棘突。使用种植机打磨左侧椎板暴露脊髓。电针组和模型组大鼠用自制硅胶片(长1 cm)填塞入胸腰椎结合部脊髓腹侧,空白组不填塞。术后按分组分笼饲养。仅电针组做电针,取穴:左右膀胱俞;左足三里、趾间;右足三里、趾间,每组分别接电针仪,连续波,频率2Hz、输出5,每天1次 20 min,连续14 d。同一名实验员于术前和术后每天采用大鼠BBB运动机能评分方法[37],对大鼠左、右后肢评分,其中第1天在大鼠从麻醉状态完全清醒后开始评分。

2.4 标本收集
术后4、7、14 d,腹腔注射戊巴比妥麻醉大鼠,呈U型剪开胸部皮肤和皮下组织,暴露心脏、剪破左心房,在主动脉弓处插入0.7×25TWLB静脉输液针,注入0.9%生理盐水冲净血液。取出脊髓剪下压迫部位,正中向头0.3 cm用于形态学观察,0.2 cm用于Nestin免疫荧光染色,向尾侧0.5 cm用于ELISA检测。
2.5 脊髓组织形态学观察和免疫荧光染色
4%多聚甲醛固定样品5 d,流水冲12 h,梯度脱水浸蜡、包埋、切片(6 μm)、脱蜡复水,焦油紫染色观察脊髓形态学变化计数正常神经元(脊髓中央管水平线以下为神经元计数区)。
切片浸入0.01 mol/L柠檬酸盐缓冲液(PH6.0)微波抗原修复,5%BSA,37 ℃孵育20 min,滴加小鼠抗大鼠巢蛋白单克隆抗体(1:50),37 ℃孵育1 h,滴加FITC标记山羊抗小鼠IgG(H+L)(1:500),37 ℃孵育1 h,抗淬灭封片液封片,采用OlympusIX71显微镜和CCD-DP72图像采集系统观察并照相。
2.6 压迫部位脊髓组织SHH含量检测
制作标准品和组织匀浆依次加入96孔板,各加两个孔做平行试验。参照Rat Hedgehog Homolog,Sonic ELISA试剂盒说明书操作,操作完毕15 min内放于酶标仪(波长450 nm)读数。
2.7 统计学方法
数据以x±s表示,采用t-检验比较分析差异显著性,P<0.01表示差异极显著,P<0.05表示差异显著,有统计学意义,P>0.05表示差异不显著。
3.结果
3.1 椎间盘脱出模型大鼠运动机能评分
由图3可见,手术当天大鼠左右后肢运动机能皆为满分21分,手术后模型组和电针组运动机能评分皆为0分,空白组皆为21分;术后电针组和模型组运动机能较术前极显著下降(P<0.01)。电针后椎间盘脱出模型大鼠运动机能明显改善,由图4,5可见第14 d大鼠左后肢运动机能评分电针组极显著高于模型组(P<0.01),由图5可见第7 d大鼠右后肢运动机能评分电针组显著高于模型组(P<0.05),第14 d电针组极显著高于模型组(P<0.01),第4、7、14 d电针组持续升高。
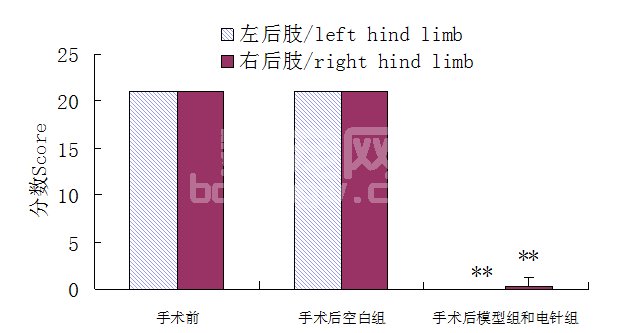
图3 手术前后大鼠左右后肢运动机能评分结果(**表示P<0.01)
Fig.3 Motor function scoring of rats’hind limbs before and after operation(**denote P<0.01)
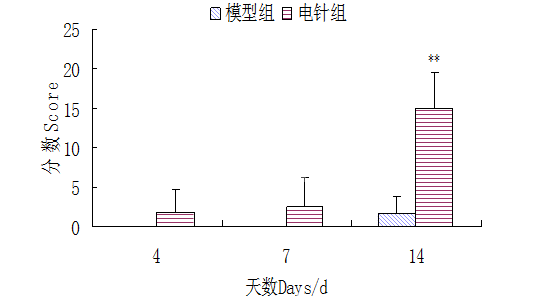
图4 电针对椎间盘脱出模型大鼠左后肢运动机能评分的影响(**表示P<0.01)
Fig.4 Effects of electro-acupuncture on left hind limb motor function in rat intervertebral disc extrusion model(**denote P<0.01)
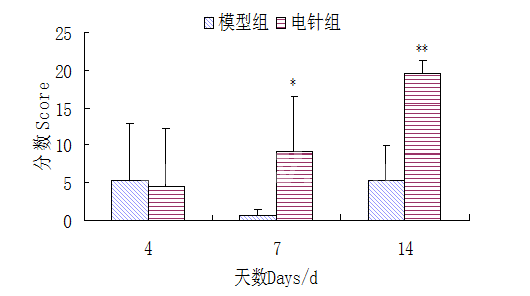
图5 电针对椎间盘脱出模型大鼠右后肢运动机能评分的影响(*表示P<0.05,**表示P<0.01)
Fig.5 Effects of electro-acupuncture on right hind limb motor function in rat intervertebral disc extrusion model(*denote P<0.05,**denote P<0.01)
3.2 压迫部位脊髓组织正常神经元观察
由图6可见,第14 d空白组神经元突起多且长,胞浆内尼氏小体清晰可见(图A黑箭头指示)。模型组神经元变小、空泡化(图B黑箭头指示),极少能观察到尼氏小体和突起。电针组神经元尼氏小体可见,但数量相较空白组明显减少,可见少量细小的突起(图C黑箭头指示)。
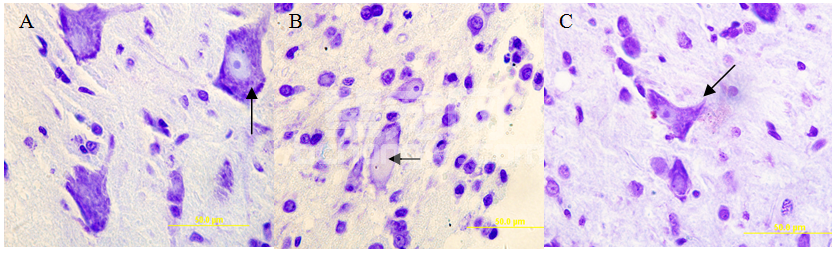
图6 脊髓灰质腹角神经元焦油紫染色(A:空白组,B:模型组,C:电针组)
Fig.6 The grey matter in ventral part of spinal cord in normal group(A:normal group,B:compression group,C:elecotro-acupuncture group)
3.3 压迫部位脊髓组织正常神经元计数
由图7可见,第4、7、14 d模型组和电针组正常神经元数量极显著低于空白组(P<0.01),第7、14 d电针组正常神经元数量极显著高于模型组(P<0.01)。
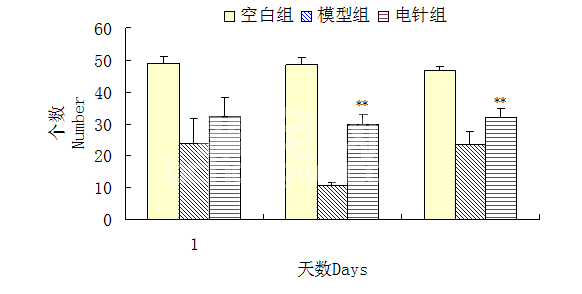
图7 电针对椎间盘脱出模型大鼠正常神经元数量的影响(**表示P<0.01)
Fig.7 Effects of electro-acupuncture on the number of normal neurons in rat intervertebral disc extrusion model(**denote P<0.01)
3.4 压迫部位脊髓组织Nestin阳性细胞观察
由图8和9可见,Nestin免疫荧光染色阳性细胞在A、D、G(空白组)为阴性。由图9可见,第7 d电针组阳性细胞数量显著高于模型组(P<0.05),第14 d电针组极显著高于模型组(P<0.01)。第14 d电针组显著高于7 d电针组(P<0.05),第7 d电针组显著高于4 d电针组(P<0.05),第4、7、14 d模型组间无显著差异。
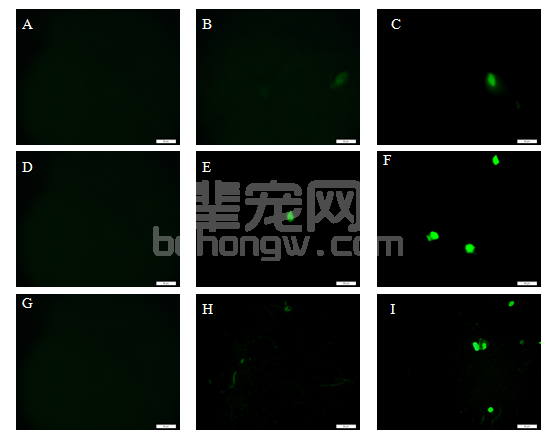
图8 压迫部位脊髓组织Nestin免疫荧光染色(A、B、C分别为4 d空白组、模型组、电针组;D、E、F分别为7 d空白组、模型组、电针组;G、H、I分别为14 d空白组、模型组、电针组;标尺=50 μm)
Fig.8 Immunofluorescence staining of Nestin in spinal cord of rats(A,B,C: shamoperated group, model group and electro-acupuncture group of four days,D,E,F: shamoperated group, model group and electro-acupuncture group of seven days,G,H,I: shamoperated group, model group and electro-acupuncture group of fourteen days,bar=50 μm)
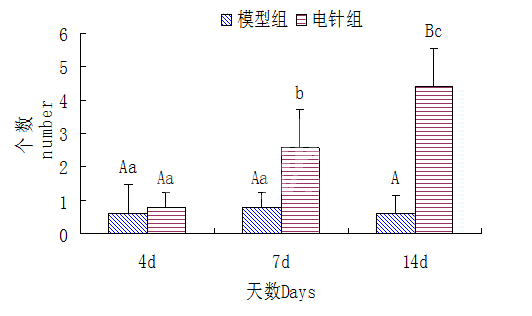
图9 压迫部位脊髓组织免疫荧光染色阳性细胞计数(小写字母不同代表P<0.05,大写字母不同代表P<0.01)
Fig.9 Statistics of immunohistochemical staining positive cells in spinal cord of rats(Different small letters denote P<0.05,different capital letters denote extremely P<0.01)
3.5 压迫部位脊髓组织SHH含量变化
由图10可见,空白组压迫部位脊髓组织SHH含量基本稳定,第4、7、14 d变化不显著;模型组第4、7、14 d SHH含量变化差异不显著,但呈现下降趋势;第7 、14 d电针组显著极显著高于模型组(P<0.01),14 d电针组显著高于7 d电针组(P<0.05)。
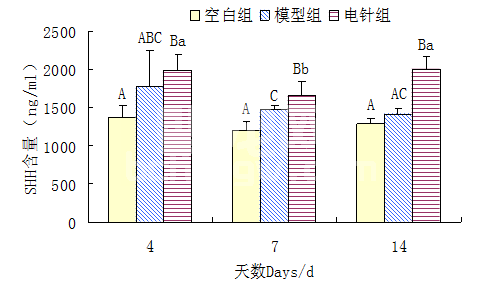
图10 大鼠压迫部位脊髓组织SHH含量(小写字母不同代表P<0.05,大写字母完全不同代表P<0.01)
Fig.10 The concentration of SHH in spinal cord of rats(Different small letters denote P<0.05,complete different capital letters denote extremely P<0.01)
4.讨论
4.1 椎间盘脱出模型的建立
本次试验自制硅胶片压迫脊髓的方法制作椎间盘脱出模型,很好的模拟了椎间盘脱出症的发生和发展,符合其病理病机。在手术前大鼠的运动机能评分均为满分21分,手术后空白组运能机评分依旧21分,术后电针组和模型组的运动机能评分均为0分,模型组和电针组和术前相比运功机能评分极显著下降(P<0.01),并出现大小便不能自主。说明本次试验成功制作椎间盘脱出模型,重复性好,后续试验数据可靠。
4.2 电针对椎间盘脱出模型大鼠运动机能的影响
中医认为椎间盘脱出症是督脉气血不足、寒湿凝滞、痰浊阻络、筋脉失养、骨髓不充所致的腰腿疼痛、肌肉无力、麻木萎缩,而针灸的作用在于通过经络和腧穴传导活血化瘀、通经活络、调节气血。本试验根据课题组前期研究结果和临床实际应用选择左右膀胱腧配以足三里和趾间作为治疗椎间盘脱出症的主要穴位。试验结果显示第4、7、14 d模型组大鼠运动机能评分上升速度较电针组缓慢,但仍表现出上升趋势,说明脊髓损伤后机体能够调动固有机能改善和修复损伤,但这种能力很有限。第14 d电针组左右后肢运动机能评分均极显著高于模型组(P<0.01),并且电针组运动机能评分呈现极显著上升的趋势。说明电针可以显著增强机体的固有机能,促进大鼠运动机能的恢复。第7 d电针组右后肢运动机能评分显著高于模型组(P<0.01),右后肢的运动机能评分大多高于同时期的左后肢运动机能评分,可能与制作椎间盘脱出模型时硅胶片压迫在脊髓左腹侧对右侧的伤害较小,所以右后肢的运动机能恢复较左后肢好。第7-10 d时电针组逐渐大小便自主,而模型组直至第14 d仍未见好转。说明电针可以改善因椎间盘脱导致的多种临床症状,最终恢复运动机能。
4.3 电针对椎间盘脱出模型大鼠脊髓组织正常神经元的影响
第14 d,模型组神经元出现明显的变性坏死空泡化,电针组形态基本完整可见少量尼氏小体和突起,说明电针可以减轻压迫部位脊髓组织神经元的变性和坏死。
第7d模型组正常神经元数量相较第4 d模型组极显著下降(P<0.01),电针组有下降但不显著,提示电针抑制正常神经元数量减少;第7、14 d电针组正常神经元数量极显著高于模型组(P<0.01)。说明电针可以升高脊髓压迫部位正常神经元数量。
4.4 电针对椎间盘脱出模型大鼠脊髓巢蛋白表达的影响
有研究认为Nestin可能是一种自我保护蛋白,神经系统发育过程中起增加细胞弹性、伸缩性、形成和维持神经干细胞形态和功能的作用,当脊髓受到损伤后Nestin起保护神经元的作用。由图8,9可见空白组无Nestin表达,模型组和电针均表达Nestin,提示Nestin在脊髓损伤后表达,符合之前学者提出的休眠的内源性神经干细胞在脊髓损伤后被激活的理论,提示椎间盘脱出脊髓受压是内源性神经干细胞被激活的可能原因;第7 d模型组Nestin阳性细胞数相较第4 d模型组有上升但差异不显著,第7 d电针组相较第4 d电针组显著上升(P<0.05),提示脊髓受压损伤后机体可以自我修复表达Nestin,电针干预后可以促进Nestin的表达;第7 d电针组Nestin阳性细胞数显著高于模型组(P<0.05),第14 d电针组极显著高于模型组(P<0.01),尤其在第14 d模型组Nestin表达回落时电针组反而极显著上升(P<0.01),说明机体自我修复表达Nestin的能力有限、持续时间不长,电针干预后呈显著上升趋势,说明电针可以升高机体的固有修复机能,促进Nestin表达。提示电针增加Nestin表达是促进神经干细胞激活的可能机制。
4.5 电针对椎间盘脱出模型大鼠SHH含量的影响
有研究表明电针可以升高促进修复的因子;降低抑制修复的因子[38,39],目前脊髓损伤后保护神经元、升高正常神经元数量的机制尚不明确,是医学界的研究热点。SHH是促进神经干细胞分化为神经元所必须的形态发生素,在胚胎发育期间SHH信号通路是脊髓腹侧运动神经元发育的必备条件,是神经干细胞分化、神经生长发育、轴突再生必要的蛋白因子。第7、14 d电针组压迫部位脊髓组织SHH含量极显著高于模型组(P<0.01),14 d电针组显著高于7 d电针组(P<0.05),模型组随着时间的发展逐步下降。提示椎间盘脱出压迫脊髓机体自我修复表达SHH,但是机体自我修复的能力有限,在无外界干预的情况下,SHH的含量逐步下降。电针后SHH含量显著上升(P<0.05),提示电针可以加强机体的自我修复功能,升高SHH含量,有利于升高正常神经元数量,为运动机能恢复提供有利条件。
5.结论
椎间盘脱出压迫脊髓导致动物机体释放多种因子保护神经细胞并促进神经细胞再生。电针可以升高促进修复的因子,为神经干细胞激活分化,神经元再生,重建神经传导回路,恢复运动机能提供有利的条件。
参考文献
[1]齋藤弥代子. 椎間板ヘルニアの保存療法[J]. Information for Vetrinaryans, 2005, 8(4): 10~12
[2] Simon J Wheeler .Nicholas J H Sharp .SMALL ANIMAL SPINAL Dignosis and Surgery [J]. 岡公代/松原 哲舟 監訳. 小動物の脊柱障害ー診断と治療―, 85-108. LLL Seminar 1998.11
[3]王雷, 姜术霞, 谢富强, 等. 针灸治疗犬椎间盘突出症90例(2000-2002)[J]. 畜牧兽医学报, 2005, 36(2): 195-197
[4]陈武. 北京における小動物臨床と鍼灸療法の現状. 日本兽医内科年会. 2005, 146-150
[5]卢知松, 陈益山, 陈武, 等. 椎间盘脱出大鼠模型的脊髓血流量变化及电针效应 [J]. 中国实验动物学报, 2011, 19(5): 381-386
[6]李格宾, 罗京京, 陈武, 等. 犬椎间盘的血液流变学变化初探[J]. 中兽医学杂志, 2009(增刊): 287-290
[7]Fehlings MG, Vawda R, Cellular treatments for spinal cord injury: the time is right for clinical trials[J]. Neurotherapeutics, 2011, 8(4): 704-720
[8]Hockfield S, Mckay RDG. Identification of major cell classes in the developing mammalian nervo-us system[J].Urosci, 1985, 5: 3310-3328
[9]Lendahl U, Zimmerman LB, Mckay RDG. CNS stem cells express a new class of intermediate fila-ment protein[J]. Cell, 1990, 60: 585-595
[10]Reynolds BA, Weiss S. Generation of neurons and astrocytes from isolated cells of the adult mam-malian central nervous system[J]. Science, 1992: 255(5025): 1707-1710
[11]谭波涛. 脊髓损伤后内源性神经干细胞的增殖与分化及相关机制研究 [D]. 重庆: 重庆医科大学, 2013年
[12]Lews E B. A gene complex controlling segmentation in Drosophila[J]. Nature, 1978, 276(5688): 565-570
[13]Maye P, Becker S, Siemen H, et al.Hedgehog signaling is required for the differentiation of ES cells into neurectodem[J]. Dev Biol, 2004, 265(1):276-290
[14]邹琳, 郭家松, 戴翔, 等. 音猬因子对神经干细胞增殖与分化的影响 [J]. 解剖学报, 2009, 40(2): 212-214
[15]Oh S, Huang X, Chiang C, Specific requirments of Sonic hedgehog signaling during oligodendrocy-te development[J]. Dev Dyn, 2005, 234(3): 489-496
[16]Merchan P, Bribian A, Sanchez-Camacho C, et al. Sonic hedgehog promotes the migration and pro-
liferation of optic nerve oligodendrocyte precursors[J]. Mol Cell Neurosci, 2007, 36(3): 355-368
[17]熊江波. 电针加推拿疗法治疗脑卒中痉挛瘫痪临床观察 [J]. 中国实用医药, 2014, 9(36): 226-227
[18]陈庆庆, 曹胜, 寇洋洋, 等. 针灸治疗中风后痉挛瘫痪的临床研究进展 [J]. 中国康复, 2013, 28(4): 390-391
[19]刑国利. 针灸治疗痿症的研究进展 [J]. 针灸临床杂志, 2004, 5: 70-71
[20]胡元亮. 中兽医学 [M]. 中国农业出版社, 2006, 516-522
[21]吴永刚, 孙忠人, 李晓艳. 针刺对大鼠脊髓损伤血流量变化影响的研究 [J]. 中国中医药科技, 1995, 2(3): 14-16
[22]刘钟杰, 刘天龙, 范开, 等. 电针对血瘀证模型绵羊血液流变学特性的影响 [J]. 中国兽医杂志, 2005, 41(3): 32-33
[23]陈武, 董亮, 王清兰. 电针对奶牛全血粘度双向调整作用的初步观察 [J]. 中国兽医杂志, 1999, (1): 34-35
[24]刘长发, 杨春壮, 姚素媛, 等. 夹脊穴对急性脊髓损伤的伤段脊髓组织中内皮素和血栓素A2的影响 [J]. 针灸临床杂志, 2003, 19(2): 52-54
[25]张尧, 邱有波, 杨拯, 等. 不同波形电针对脊髓损伤大鼠运动功能恢复的影响 [J]. 中国康复医学杂志, 2002, 27(12): 1100-1101
[26]李志刚, 刘如春, 耿直, 等. 电针对急性脊髓损伤大鼠差异性表达基因及钙离子作用的实验研究 [J]. 北京中医药大学学报, 2008, 31(7): 486-489
[27]崔晓军, 李伊为, 陈东风, 等. 电针百会对脊髓损伤大鼠脊髓组织3种亚型NOS表达及NO含量的影响 [J]. 中医药学刊, 2003, 21(8): 1270-1271
[28]张莹莹, 李俊岑, 饶莹, 等. 电刺激对大鼠脊髓损伤后神经胶质纤维酸性蛋白与白细胞介素-1α表达的影响 [J]. 中国康复理论与时间, 2011, 17(9): 844-847
[29] 汪吉明, 孔抗美, 崔华中, 等. 电针对脊髓损伤后神经生长相关蛋白GAP-43表达的影响 [J].广东医学, 2007, 28(1): 40-41
[30]赵伟. 电针对脊髓损伤后硫酸软骨素蛋白多糖的影响 [J]. 山东大学学报(医学版), 2011, 49(3): 73-75, 80
[31]乔鸿飞, 兰宾尚, 刘亦恒. 电针刺激对脊髓损伤大鼠NF200GFAP表达的影响 [J]. 中国康复医学杂志, 2008, 23(7): 635-637
[32]上官豪, 柳维林, 陈文列, 等. 电针曲池、足三里穴对缺血再灌注损伤大鼠线粒体Caspase-3途径诱导细胞凋亡的影响 [J]. 中国康复理论与实践, 2015, 21(8): 900-904
[33]徐维蓉, 王强利, 王奕, 等. 电针对脊髓损伤模型大鼠热休克蛋白70及其mRNA的影响 [J]. 上海针灸杂志, 2009, 28(9): 550-553
[34]何娟, 王忠华. 电针对脊髓损伤大鼠星形胶质细胞的影响及机制 [J]. 西安交通大学学报(医学版), 2013, 24(2): 253-257
[35]Blechingberg J, Holm IE, Nielsen KB, et al. Identification and characterization of GFAPK, a novel glial fibrillary acidic protein isoform[J]. Glia, 2007, 55(5): 497-507
[36]De Keyser J, Mostert JP, Koch MW. Dysfunctional astrocytes as key players in the pathogenesis of central nervous system disorders[J]. J Neurol Sci, 2008, 267(1-2): 3-16
[37]Becker D, Gary DS, Rosenzweig ES, et al. Functional electrical stimulation helps replenish progenitor cells in the injured spinal cord of adult rats[J]. Exp Neurol, 2010, 222(2): 211-218
[38]吴金海, 袁章, 杨拯, 等. 电针对脊髓损伤后蛋白表达影响的研究 [J]. 中国医学杂志, 2009, 25(24): 4242-4243
[39]时素华. 电针对大鼠脊髓损伤后细胞凋亡相关因子及神经再生的影响 [D]. 北京: 北京中医药大学, 2011
