

慢性肾功能衰竭(Chronic renal failure,CRF)是猫常见的疾病,也是引起猫死亡的常见原因。CRF在任何年龄的动物中均可见,但常发于老年动物。猫年龄越大,患此病的几率越大。一项研究表明,53%的猫患CRF的年龄在7岁以上。另一研究表明肾衰的猫中,37%猫的年龄小于10岁,31%猫在10到15岁之间,32%猫的年龄>15岁。慢性肾衰病因不明,可能是多囊肾、泌尿道结石、肾脏淋巴瘤、肾盂肾炎、肾小管间质性肾炎及肾脏淀粉样变性等引起[1]。
1 病理生理学
慢性肾衰时正常功能的肾单位已丧失75%以上,不足25%的肾单位在进行超负荷的工作。肾单位丧失及肾小球滤过率降低是肾衰基本的病理学变化。肾小球滤过率的丧失导致许多主要由肾脏排泄的物质,如肌酐、尿素氮、磷、胃泌素等,在血浆中的浓度增加。
肾脏不但有排泄代谢废物和维持体液及电解质平衡的功能,还能分泌多种激素,如促红细胞生成素,故慢性肾衰时常见非再生性贫血。维生素D3经肠道吸收后转变为有活性的1,25-二羟维生素D3的过程需要肾脏的参与,肾衰会使此过程受影响,导致离子钙偏低,进而促发甲状旁腺机能亢进和骨营养不良。
2 症状与诊断
CRF猫的症状具有多样性,如体重下降、多饮多尿、呕吐、黏膜苍白、口臭、口腔溃疡或胃肠道溃疡,如图 1所示。
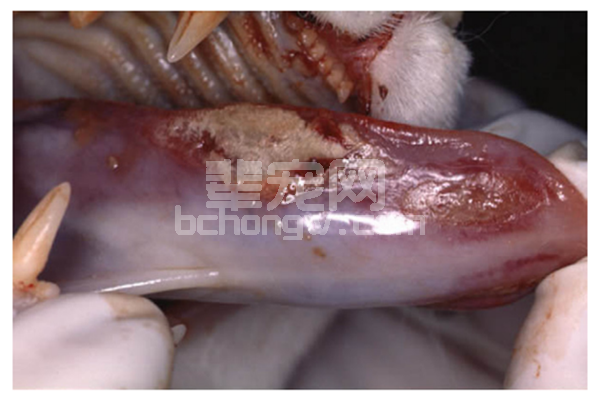
图1 慢性肾衰猫的口腔炎及舌炎[2]
肾衰时尿毒素血症引起胃肠道溃疡,血液经胃肠道丢失,同时肾脏产生的促红细胞生成素减少,故动物常出现非再生性贫血。
2.2生化检查
常出现氮质血症(血清肌酐、尿素氮浓度升高)。氮质血症分为肾前性、肾性及肾后性。肾前性多由脱水、低血容量、低血压等因素引起;肾后性常为泌尿系统结石或炎症等造成尿液排出受阻等因素引起;肾性氮质血症往往是肾脏本身损伤导致其分泌与排泄功能失常引起。
2.3超声检查
常出现肾脏皮髓分界不清、皮质回声增强、肾萎缩、形态不规则,如图 2。注意应通过影像学检查排除肾后性因素的影响,如肾结石及肾盂肾炎。
可见肾脏皮质回声增强、皮髓分解不清和肾脏偏小。
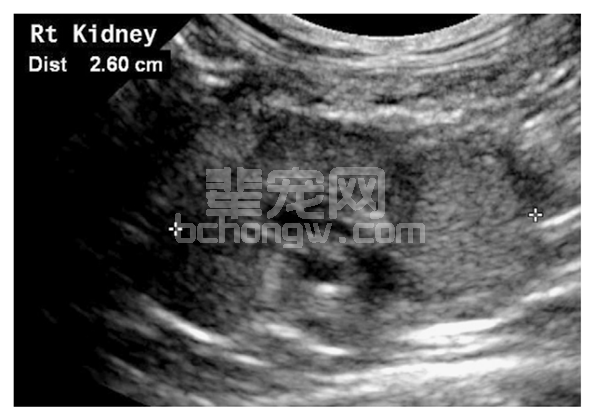
图2 慢性肾衰猫的超声影像[3]
2.4 尿检
肾衰时尿液浓缩能力不足,尿比重可能处于1.008-1.030。当存在泌尿道感染时,可能看到白细胞及细菌。尿液中同时存在白细胞及细菌提示泌尿道感染,只存在细菌不存在白细胞可能是人为污染造成的。猫的尿液中仅存在白细胞不存在细菌并不是泌尿道感染的特异性指征。若怀疑同时存在泌尿道感染可做细菌培养确认并做药敏试验选择敏感的抗生素。
2.5 血气检查
电解质在肾小球滤过,在近端小管重吸收,肾衰时肾小球的滤过及肾小管的重吸收异常会导致电解质及酸碱平衡的紊乱。其中酸中毒及低血钾较为常见。酸中毒是由于肾脏排泄酸减少及对HCO3-重吸收减少引起的。低血钾可能是由于厌食导致从食物中摄取钾的减少及肾脏丢失钾过多等引起的。低血钾常表现为活动量减少、严重的肌无力,如低头、共济失调,如图3。

图3 CRF低血钾的猫[3]
2.6 慢性肾衰分级
根据IRIS(International Renal Insufficiency Society)分级标准,CRF分级如表1所述。

还要进行什么检查?
2.7测量血压
肾脏球旁器的颗粒细胞可分泌肾素,肾脏通过肾素-血管紧张素-醛固酮系统及激肽-缓激肽-前列腺素系统调节钠、水平衡进而调节血压,肾衰时此调节过程发生紊乱导致高血压。高血压可进一步加剧肾脏损伤,另外会对中枢神经系统(central nervous system,CNS)、视网膜、心脏及肾脏产生影响。收缩压>160mmHg会增加靶器官损伤的风险。IRIS依据血压区分肾衰亚级见表2。

2.8 检测蛋白尿
检测蛋白尿可反映肾小球结构或功能的变化。人和犬中蛋白尿的出现是肾病进一步发展的重要指征。尿试纸检测蛋白尿是一种半定量的方法。蛋白尿可能是肾前性、肾性或肾后性原因引起的。肾前性原因包括血红蛋白尿、肌红蛋白尿;肾后性蛋白尿多由尿道感染或严重血尿引起[4]。肾性蛋白尿常是肾小球疾病引起,肾小管疾病(如范可尼综合征)和肾间质异常引起蛋白尿的情况较少见。尿蛋白肌酐比(Urinary protein/creatinine ratio,UPC)可定量蛋白尿。IRIS依据肾性蛋白尿对肾衰进行亚级区分的方法如表3。注意在这之前应确定已经排除肾前性及肾后性的异常。

3 治疗
3.1纠正脱水及电解质紊乱
CRF时肾脏尿液浓缩能力不足可出现多尿,因此引起脱水。建议静脉输液纠正脱水,静脉输液的液体优先选择等渗液乳酸林格,脱水量(体重×脱水程度×1000ml)可在6h左右补充完。脱水得到纠正后可按维持量(40-60ml/kg/h)+继续丢失量计算所需输液总量。
良好水合状态的长期维持可通过增加胃肠道水的摄入量及皮下补液进行。粮食中加入温水,饲喂罐头(湿粮),喝流动的水均能提高动物饮水量。一些动物,尤其是猫,摄入量常不能满足需要,故可选择乳酸林格液进行皮下补液。猫皮下输液的量常为75-150ml,q12-72h。乳酸林格液,可加入氯化钾(每100ml液最多加1.48ml KCl)可达到补钾的作用,但所加钾离子浓度过高会对组织产生刺激。注意有些动物不能忍受皮下输液。必要时可放置鼻饲管、食道饲管、胃饲管,放置饲管可便于日常喂食及喂药。
3.2 纠正低血钾
低血钾时可通过静脉注射补钾,KCl补充量见表4所示[2],补钾时注意输液速度不能过快,否则会引起心脏毒性。低血钾治疗的目标是使血钾位于正常范围区间的上半部分。除了静脉补钾外,在动物恢复食欲后,也可通过口服葡萄糖酸钾(猫:0.47g/kg,po,q12h)或柠檬酸钾(75mg/kg,po,q12h)达到补钾的目的,但要注意复查血气,从而调整口服补钾药的剂量。

3.3 纠正酸碱紊乱
酸中毒可通过静脉注射NaHCO3纠正,公式如下:
0.5×BW(kg)×(19-当前HCO3-)
可分2次给药。
口服柠檬酸钾(75mg/kg,q12h)及NaHCO3(8-12mg/kg,q8-12h)也可达到纠正酸中毒的目的,HCO3-维持在16-24mmol/L的水平较为适宜。
3.4 保护胃肠粘膜
正常情况下胃泌素主要通过肾脏灭活,CRF时胃泌素灭活受到影响会导致胃酸分泌过多损伤胃肠道,另外,尿毒素血症也可引起胃肠道异常,可给予制酸药物(如H2受体拮抗剂、质子泵抑制剂)抑制胃酸分泌,保护胃肠道。硫糖铝(0.25-0.5g/只,po,q6-12h)在酸性条件下可与粘膜下层的胶原结合,可能有一定的细胞保护作用。
3.5 抗生素的使用
肾衰动物要停止使用对肾脏有损伤的药物,同时要注意识别并治疗任何肾前性及肾后性异常,任何尿道感染均可能造成肾小球肾炎,故存在尿道感染者应积极治疗。Joanna D White等调查了84只CRF猫中泌尿道感染的流行率,结果发现约30%(28/86)猫的尿液细菌培养结果为阳性,尿道感染最常见的细菌为大肠杆菌,其最敏感的抗生素为阿莫西林-克拉维酸,其次为阿莫西林[5]。
3.6 高血压的治疗
高血压可加重CRF的发展,加重蛋白尿,也可导致左心室肥大,严重者出现左心衰,神经症状,如癫痫、脑缺血、眼睛视网膜出血、前房积血与失明[1]。若不是已存在视网膜损伤或神经症状或动脉收缩压(systolic blood pressure,SBP)高于180mmHg,高血压并不需要立即治疗[2]。II-IV级CRF动物动脉血压持续高于160mmHg,或I级CRF动物血压持续高于180mmHg可考虑治疗高血压。存在高血压的CRF病猫通过治疗应使血压控制在120mmHg-160mmHg之间。IRIS建议的高血压治疗措施如下:
(1)低钠饮食:没有研究证明低钠饮食可降低血压。若考虑低钠饮食,要逐渐过渡,并配合药物治疗。
(2)钙离子通道阻断剂(Calcium channel blocker,CCB),如氨氯地平(0.125-0.25mg/kg,q24h)。
(3) 若以上效果不明显,可加倍氨氯地平剂量(0.25-0.5mg/kg,q24)。
(4)若上述效果仍不能较好的控制高血压,考虑肾素-血管紧张度-醛固酮系统抑制剂,如血管紧张素转换酶抑制剂(angiotensin converting enzyme inhibitor,ACEI,如贝那普利)或血管紧张素受体抑制剂(angiotensin receptor blocker,ARB,如替米沙坦:0.5-1mg/kg,q24h,最大可达5mg/kg,q24h)与CCB类药物联合使用。
注意脱水没有得到纠正的动物不要使用CCB/ACEI/ARB类药物,因为水合状态不良者使用此类药物会导致GRF急剧下降。
通常高血压需要长期治疗,注意在治疗期间应监测血压并根据血压监测结果调整药物剂量,避免出现血压<120mmHg的情况,待病情稳定后,也应该每3个月监测1次血压。
作用于肾素-血管紧张素-醛固酮系统(Renin-angiotensin-aldosterone System,RAAS)的药物降血压效果只有10%-15%,先用RAAS抑制剂至最高剂量但仍不能较好的控制血压时建议使用钙离子通道阻断剂,如氨氯地平(最高剂量0.75mg/kg/d,可分次使用)。
猫单独使用氨氯地平可达到较好的降血压的作用,并且可能可同时改善蛋白尿。氨氯地平使用剂量:猫:0.625mg/kg(<5kg),1.25mg/kg(>5kg),如需要可加倍剂量。
3.7 蛋白尿的治疗
研究表明血清肌酐浓度及蛋白尿是影响CRF猫存活时间的重要因素[4-6]。蛋白尿越严重,动物生存时间越短[6, 7]。人类慢性肾衰的研究表明,降低尿蛋白可延缓肾病的发展,但在犬和猫上缺乏此类证据。IRIS推荐的蛋白尿治疗方法如下:
(1)使用RAAS抑制剂(ACEI及ARB),如贝那普利/依那普利,0.25-0.5mg/kg,po,q12-24h,最大可达2mg/kg,q12h;饲喂肾脏处方粮。
(2)检测治疗的反应
血肌酐稳定,UPC下降预失着对药物治疗反应良好。
血肌酐浓度升高或UPC升高预失着肾病渐进性发展。
脱水动物使用ACEI会使GRF急剧下降。故可先纠正脱水,再使用药物。依那普利通过肾脏排泄,而贝那普利可由胆汁排泄故可减轻肾脏负担,故贝那普利的使用优于依那普利。使用ACEI类药物1-2周应后监测肌酐、血钾浓度和血压,血钾<6.0mmol/L,SBP>120mmHg,肌酐浓度稳定或仅有轻微伤上升(I、II级CRF肌酐浓度上升值<基础值的30%,III级CRF肌酐浓度上升值<基础值的10%,IV级CRF肌酐基本无上升)是可以接受的。
ARB类药物有替米沙坦和洛沙坦,替米沙坦比洛沙坦更有效,但洛沙坦使用更广泛。猫使用洛沙坦效果较差。
替米沙坦是脂溶性的,半衰期比洛沙坦短,它与血管紧张素I受体的结合力更强,释放的更缓慢。在降血压方面替米沙坦和氨氯地平同样有效,比贝那普利效果好。研究表明,蛋白尿的猫在为期6个月的控制治疗中,替米沙坦和贝那普利同样有效。在这6个月中,替米沙坦在改善蛋白尿上一直有效,而贝那普利只在最初有效。
蛋白尿治疗期间至少每3个月监测一次UPC、尿检、血压及血浆白蛋白及肌酐和血钾浓度。改变剂量或使用新药物时应1-2周检测一次。使用ACEI或ARB类药物1-2周后要检测UPC、血钾、血磷及血压以确定药物没有恶化肾功(如肌酐浓度上升>30%,血磷浓度升高,或低血压)。
大部分犬猫UPC每天都在变化,UPC>4者变化更大。犬猫蛋白尿最首选药物为ACEI,替米沙坦也可作为首选。1-2周检测肌酐、血钾、UPC及血压。若肌酐、血钾、UPC及血压升高值超过可接受范围而蛋白尿明显改善可考虑降低使用剂量或换用其他药物并重新监测。若肌酐、血钾、UPC及血压升高值可接受,蛋白尿改善程度不理想可考虑增加剂量或增加另一种药物。两方面均达到可接受程度后,维持此治疗方案,每3-4个月监测一次。IRIS中CRF分级为I、II级者肌酐上升程度不能超过基础值的30%,III级不能超过基础值的10%。若超出此范围可考虑调节剂量。IV级肾衰者通常不能忍受肾功的进一步恶化,否则会恶化临床症状。若血钾<6mmol/L,肾功下降的范围还可接受,每4-6周检测肌酐、血钾、UPC及血压,若ACEI使用最大剂量仍到不到理想的控制效果,可考虑加入ARB类制剂[7]。
高血钾(有心脏毒性)是犬使用RAAS抑制剂常见的副作用,但猫不常见。血钾>5.5mmol/L需密切监测。血钾>6-6.5应用药干涉。血钾<6mmol/L可做心电图确定高血钾对心脏的影响。真性高血钾可通过降低ACEI或ARB剂量得到改善,停用螺内酯,吃低钾粮(肾衰处方粮有补充钾)。高血钾需要透析者很少。低钾饮食可有效地纠正CRF犬的高血钾。
3.8 降低血磷
高血磷可导致低血钙,进而导致甲状旁腺机能亢进。甲状旁腺机能亢进可导致骨营养不良。不同级别肾衰血磷所应控制的范围见表5。
磷酸盐结合剂可用于降低血磷浓度,常见的药物有钙制剂(30-90mg/kg,po,q24h),如碳酸钙、醋酸钙,铝制剂(30-90mg/kg,po,q24h),如氢氧化铝、碳酸铝,非钙非铝制剂,如碳酸镧(30-90mg/kg,po)、司维拉姆(400-1600mg/只,po,q8-12h)。磷酸盐结合剂主要作用是降低通过食物吸收的磷,使用时需要把总药量分次服用,保证每次均与食物同服。
3.9 非再生性贫血
CRF时促红细胞生成素的减少,厌食导致营养不良使红细胞生成减少,红细胞寿命缩短及胃肠道丢失血细胞等多种原因共同租用导致机体贫血。猫PCV为12%-15%时考虑治疗贫血,治疗的目的是使PCV维持在25%-35%,贫血的治疗可从以下三方面着手:
(1)减少胃肠道出血:尿毒素性胃肠炎较常见。H2受体阻断剂及质子泵抑制剂可减少胃酸分泌,硫糖铝也可用作抗酸药同时它也有磷酸盐结合剂的特性故可用于治疗胃溃疡。
(2)提高动物营养水平:补充铁,减少胃肠道出血引起的铁缺乏,可用药物如硫酸亚铁(50-100mg/只,po,q24h,右旋糖酐铁,50mg/只,iv,q3-4w)。
3 刺激红细胞的产生:促红细胞生成素(erythropoietin),100IU/kg,皮下注射,每周3次。使用促红细胞生成素可能促使机体产生相应抗体,建议红细胞压积<20%时使用。若刚开始使用药物有效,后来出现红细胞压积下降则应考虑机体是否产生了相应的抗体。与erythropoietin相比,darbepoetin维持时间更长,诱导机体产生抗体的几率更小。Darbepoetin剂量为1μg/kg,q1w,3-4周可产生效果。
3.10 营养控制
每日热量需要依静息能量需要(resting energy requirement,RER)进行评估,公式为70×BWkg0.75。根据动物活动量大小,动物肥胖或消瘦情况等因素,用RER乘以相应的系数得到维持能量值,活动量大、消瘦的成年猫此系数可为1.0-1.4,活动量少、肥胖的猫此系数可为0.8-1.0。米氮平(1.875–3.75 mg,po,q48-72h)可用来刺激食欲,同时还具有止吐作用。对于长期没有食欲或不能进食的动物可以考虑安置鼻饲管、食道饲管及胃饲管[2]。
健康肾单位的丧失使剩余肾单位血压升高,此过程称为肾小球内高血压。长时间的肾小球内高血压可造成肾脏的进一步损伤。研究表明含Ω-3脂肪酸的饮食可降低肾小球内高血压,维持肾小球滤过率并延长犬存活时间[8]。另外它还可降低高胆固醇血症,抑制炎症。Ω-6与Ω-3脂肪酸的比值为3:1-5:1对肾衰动物更有利,许多肾衰处方粮均含有此比例的脂肪酸。
日粮中的蛋白质代谢产生有机酸加剧酸中毒,另外蛋白质会刺激胃酸的分泌加重肾衰动物胃肠道溃疡或出血,故应限制肾衰动物蛋白质的摄入量。
CRF动物多尿使B组维生素缺乏,B组维生素缺乏是动物厌食或低血氧的部分原因。虽然肾脏处方粮中常补充B组维生素,但文献证明CRF动物缺乏B族维生素并不常见。
限制饮食中的蛋白质和磷可降低CRF动物尿毒症的严重程度,减弱肾病继发的甲状旁腺机能亢进的严重程度,从而延长CRF猫的存活时间。
处方粮是CRF治疗中的重要组成部分。处方粮中限制了蛋白质、钠及磷的含量,增加钾、B组维生素、碱性物质及Ω-3脂肪酸的含量。处方粮可增加II级及其以上CRF动物的生活质量及生存时间,但其对于I级肾衰的作用并不确定[9]。
4 预后
肾衰分级、血磷浓度与CRF预后息息相关。研究表明,I、II级CRF病猫的中位生存时间为1151天,III级CRF病猫的中位生存时间为778天,IV级CRF病猫的中位生存时间为103天[10]。Jonathan N等人的研究表明,血清肌酐浓度、UPC检测值、白细胞的增多、血磷及尿素氮浓度、红细胞压积的降低都可影响CRF病猫预后[11]。
参考文献
[1] Jacob F, Polzin D J, Osborne C A, et al. Association between initial systolic blood pressure and risk of developing a uremic crisis or of dying in dogs with chronic renal failure. J Am Vet Med Assoc, 2003,222(3):322~329
[2] Bartges J W. Chronic kidney disease in dogs and cats. Vet Clin North Am Small Anim Pract, 2012,42(4):669~692
[3] DACVIM D J C D, DACVIM S P D D. Canine.and.Feline.Nephrology.and.Urology. 2nd. 2010
[4] Lees G E, Brown S A, Elliott J, et al. Assessment and management of proteinuria in dogs and cats: 2004 ACVIM Forum Consensus Statement (small animal). J Vet Intern Med, 2005,19(3):377~385
[5] White J D, Stevenson M, Malik R, et al. Urinary tract infections in cats with chronic kidney disease. Journal of Feline Medicine and Surgery, 2013,15(6):459~465
[6] Elliott J, Syme H M. Proteinuria in chronic kidney disease in cats--prognostic marker or therapeutic target? J Vet Intern Med, 2006,20(5):1052~1053
[7] Vaden S L, Elliott J. Management of Proteinuria in Dogs and Cats with Chronic Kidney Disease. Vet Clin North Am Small Anim Pract, 2016,46(6):1115~1130
[8] Ross S J, Osborne C A, Kirk C A, et al. Clinical evaluation of dietary modification for treatment of spontaneous chronic kidney disease in cats. J Am Vet Med Assoc, 2006,229(6):949~957
[9] Polzin D J. Chronic Kidney Disease in Small Animals. Veterinary Clinics of North America: Small Animal Practice, 2011,41(1):15~30
[10] Boyd L M, Langston C, Thompson K, et al. Survival in Cats with Naturally Occurring Chronic Kidney Disease (2000-2002). Journal of Veterinary Internal Medicine, 2008,22(5):1111~1117
[11] N K J, S T, A G M D. Prognostic Factors in Cats with Chronic Kidney Disease. 2007,5(21):906~916