犬钩端螺旋体病3例
摘要:犬钩端螺旋体病系由犬感染钩端螺旋体属引起的人兽共患传染性细菌疾病。某动物医院于2014年12月至2016年4月共确诊5例犬钩端螺旋体病。文章对这5例中具有可查的较完整诊治过程的3例进行了回顾分析,发现病犬可能接触过外界水源,发病时往往表现为精神沉郁、体温升高、黄疸、厌食或呕吐,在实验室检查中常见肝肾损伤和贫血,其确诊推荐采集尿液做PCR检测,使用抗生素治疗病犬可起到积极效果。
关键词:犬;钩端螺旋体;PCR;青霉素
钩端螺旋体(以下简称钩体)易在潮湿环境中生存,可穿透嘴、鼻、眼的完整黏膜或有损伤、经水泡软的皮肤,主要通过间接传播感染机体。钩体的血清型很多,但犬只在感染黄疸出血型和犬型等致病性强的血清型时,才表现临床症状[1]。
1.病例基本信息、病史及临床症状
病例1为雄性、2.5岁西伯利亚雪橇犬,病例2为雄性、5岁泰迪犬,病例3为雄性、4岁可卡犬。3只病犬就诊时均表现为精神沉郁、体温升高、厌食或呕吐、饮欲尚可、黄疸,其中病例1曾游泳,病例3去过水坑玩耍,病例2接触外界水源的情况未知。另外,病例1于就诊的前天早晨发生过抽搐。
2.实验室检查
2.1 血常规检查
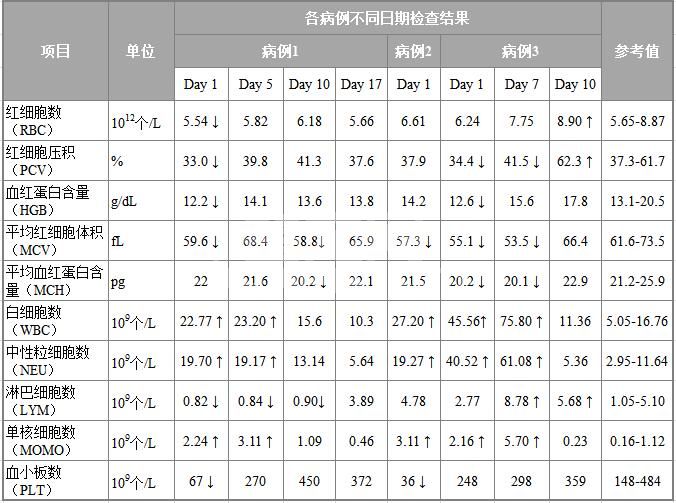
初诊日(Day 1)检查结果显示3只病犬患轻度贫血或血小板偏低,且均发生急性炎症。另外焦虫镜检和红细胞形态未见异常。检查结果见下表1。
表1 病例1、2、3血常规检查
2.2 生化检查
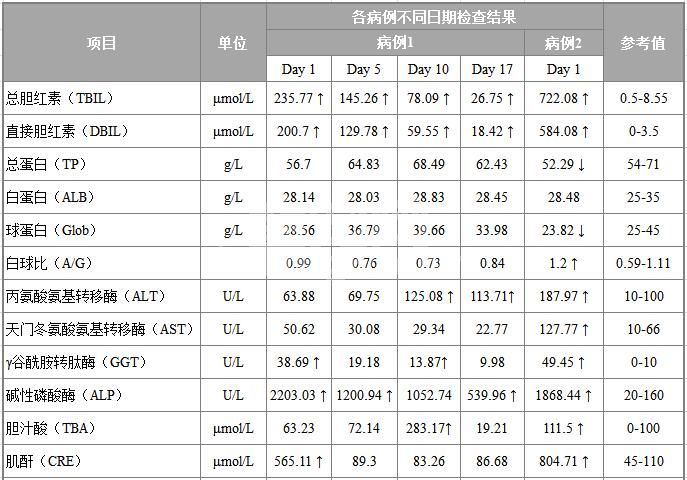
初诊日(Day 1)检查结果显示,病例1和病例2出现肝损伤或胆汁淤积,且均发生肾衰,肌肉损伤以及Na、Cl的轻度降低。病例3只做了UREE的检测,发现其值严重超标,也提示肾衰。病例1、2的生化检查结果如下表2
表2 病例1、2生化检查
2.3 超声检查
基于之前的检查结果,超声主要检查了消化和泌尿系统,下面列出异常影像。
病例1肝胆、肾脏超声影像分别如图1-1,1-2。超声提示肝脏轻度增大,回声轻度降低,可能是被动充血或急性肝炎;肾皮质回声略低于脾脏,需结合肾功评估。
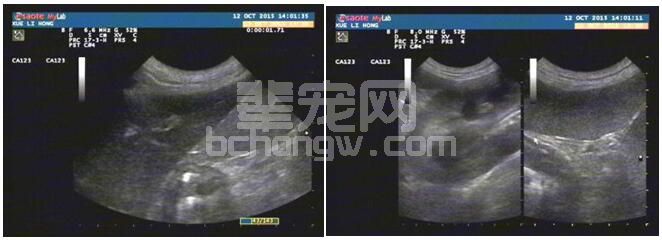
图1-1病例1肝脏影像 图1-2 病例1肾脏(左)和脾脏影像
病例2左肾和胰腺右叶的超声影像分别如图2-1,2-2。超声提示肾偏大且皮质回声增强,左肾积液,考虑急性肾损伤;胰腺形态改变,需考虑胰腺炎;
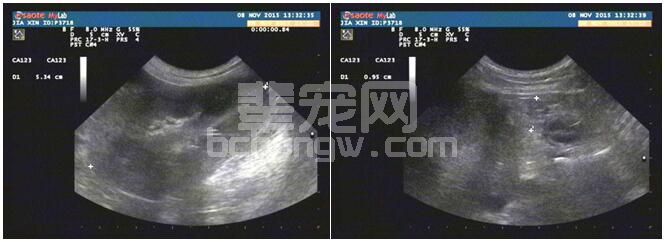
图2-1 病例2左肾影像 图2-2 病例2胰腺右叶影像
病例3左右肾脏超声影像分别如下图3-1,3-2。超声提示肾脏增大,双肾可能呈慢性肾病经过。
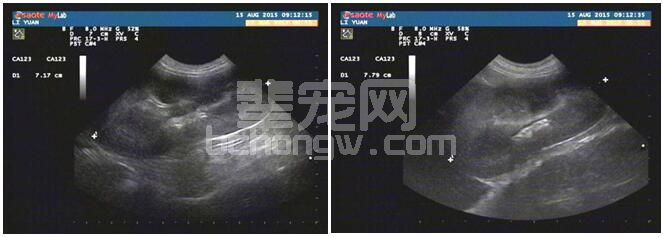
图3-1 病例3左肾影像 图3-2 病例3右肾影像
2.4 PCR检查
对3个病例进行了尿样中犬钩体的PCR检查,检查结果均为阳性。对病例1还做了犬瘟热PCR检查,检查结果为阴性。
以上各项检查结合PCR检查,即可确诊3个病例均为犬钩体病。
2.5 其他检查
病例2高度怀疑胰腺炎,对其做了SNAPshot Dx检查,结果为cPL异常,很可能是患犬在感染钩体后继发胰腺炎。
3.治疗及转归
病例2由于病情严重,已于就诊当天不幸死亡。下面介绍病例1、3的治疗转归,检查指标变化参见上述各表格。
3.1 病例1治疗及转归
静注生理盐水,以促进肌酐和尿素氮的排出并补充Na、Cl等电解质,同时辅以其他补充能量、促进代谢药物。由于青霉素类和头孢菌素类抗生素可以有效地抑制钩体增殖,但在促进钩体排出的作用上不如四环素类抗生素[2,3]。因此,治疗时在静注液体中加入氨苄西林,同时口服强力霉素。此外,给予保护肝肾和控制呕吐的药物。
病例1在随后的第5、10、17、65天前来复诊,病情逐步好转,治疗逐渐由输液改为口服,期间取第10、17天的尿液进行犬钩体的PCR检测,结果均为阴性,第65天的检查指标全部正常,最终治愈。
3.2 病例3治疗及转归
病例3初诊时,PCR检查尚未完成,主要对其进行了保护肝肾、消炎、止吐及补充能量的输液治疗。在确诊钩体病后,该犬主要在外院治疗,一个星期后电话回访,主诉病犬精神、食欲较好,正使用抗生素治疗。
4.讨论
钩体在进入机体血管后,快速增殖并传播到各组织器官。潜伏期7天左右。
急性钩体感染时,钩体在血管内大量繁殖可引起炎症,而钩体内毒素又可刺激中性粒细胞活化[4],进而促进炎症。炎症因子还可能导致血小板活化、抑制纤维蛋白溶解等血凝异常,但学术界对此说法仍有争议[5,6]。因此,病例1、3的贫血可能由血管炎引起的血管内皮损伤和出血造成,但也不排除肾脏损伤、促红细胞生成素减少造成。病例1、2血小板偏低可提示钩体引起的异常血凝。
随着血清中和抗体的升高,钩体在大多数器官内被排除,但在肾内仍可持续增殖并通过尿液排毒[7,8],排毒时间从数天到数月不等,且有间歇性[9,10]。这使得肾衰在钩体感染中最为常见。肾衰后肾小管重吸收钠、钾、氯和排磷能力下降,可出现低血钾、低血钠、低血氯、高血磷。病例1、2、3生化肾指标的异常和肾脏影像的异常,可提示肾衰。病例1、2的Na、Cl轻度降低,可能是肾衰表现,但也不能排除离子经呕吐流失。
钩体在肝脏内繁殖,可引起慢性肝炎、肝脏纤维化和肝衰竭,造成肝细胞性黄疸。病例1、2生化检查中DBIL显著上升,非溶血性黄疸,而超声检查中胆囊未见异常,又可排除阻塞性黄疸,因此病例1、2的黄疸属于肝细胞性,即钩体损害肝脏造成。
在某些情况下,钩体感染也可以导致肺损伤[11]、脑膜炎[12]、生殖道炎症[13]和肌肉损伤[14]。病例1和病例2的CK升高提示肌肉损伤,但LDH的升高无特异指示意义。病例1的犬瘟热PCR检查结果为阴性,说明该犬的神经症状(抽搐)是由钩体感染引起的脑膜脑炎的表现。
对该病的确诊,推荐使用PCR方法,样品首选是尿液。但如果要确诊病犬康复,应至少进行两次PCR检查并且为阴性结果,因为肾脏排出钩体具有间歇性的特点。治疗上,抗生素的运用是必要的。如上述病例1的治疗,青霉素类或头孢菌素类与四环素类配伍,可起到良好的治疗效果。
在临床上,若遇到非老年、接触过外界水源,且伴有黄疸、体温升高、尿黄、呕吐等症状的犬时,尤其应将犬钩体病作为一种怀疑疾病进行排查,同时要注意防止人的感染。
参考文献
[1]王飞,刘士国.犬钩端螺旋体病的防治措施[J].农业灾害研究,2015,(7):22-23.
[2]Truccolo J, Charavay F, Merien F, et al. 2002. Quantitative PCR assay to evaluate ampicillin, ofloxacin, and doxycycline for treatment of experimental leptospirosis. Antimicrob Agents Chemother 46:848-853.
[3]Yoder HW, Bergman EN, Gleiser CA. 1957. Experimental canine leptospirosis: IV. Evaluation of selected antibiotics in the therapy of acute experimental Leptospira icterohaemorrhagiae infections in immature dogs. J Infect Dis 100:257-267.
[4]Isogai E, Hirose K, Kimura K, et al. 1997. Role of platelet-activating factor (PAF) on cellular responses after stimulation with leptospire lipopolysaccharide. Microbiol Immunol 41:271-275.
[5]Wagenaar JFP, Goris MGA, Sakundarno MS, et al. 2007. What role do coagulation disorders play in the pathogenesis of leptospirosis? Trop Med Int Health 12:111-122.
[6]Yang H-L, Jiang X-C, Zhang X-Y, et al. 2006. Thrombocytopenia in the experimental leptospirosis of guinea pig is not related to disseminated intravascular coagulation. BMC Infect Dis 6:19.
[7]Chassin C, Picardeau M, Goujon JM. 2009. TLR4-and TLR2-mediated B cell responses control the clearance of the bacterial pathogen. Leptospira interrogans. J Immunol 183: 2669-2677.
[8]Monahan AM, Callanan JJ, Nally JE. 2009. Host-pathogen interactions in the kidney during chronic leptospirosis. Vet Pathol 46: 792-799.
[9]Brunner KT, Meyer KF. 1949. Streptomycin in the treatment of leptospira carriers. Experiments with hamsters and dogs. Proc Soc Exp Biol Med 70:450-452.
[10]Childs JE, Schwartz BS, Ksiazek TG, et al. 1992. Risk factors associated with antibodies to leptospires in inner-city residents of Baltimore: A protective role for cats. Am J Public Health 82:597-599.
[11]Subash GS, Harling D. 2007. Acute lung injury and multi-organ dysfunction; an unusual manifestation of leptospirosis. Br J Anaesth 549-550.
[12]de Souza AL. 2006. Neuroleptospirosis: unexplored and overlooked. Indian J Med Res 124:135-128.
[13]Rossetti CA, Liem M, Samartino LE, et al. 2005. Buenos Aires, a new Leptospira serovar of serogroup Djasiman, isolated from an aborted dog fetus in Argentina. Vet Microbiol 107:241-248
[14]Mastrorilli C, Dondi F, Agnoli C, et al. 2007. Clinicopathologic features and outcome predictors of Leptospira interrogans Australis serogroup infection in dogs: a retrospective study of 20 cases (2001–2004). J Vet Intern Med 21:3-10.
